動態(tài)RNA甲基化修飾及其在哺乳動物發(fā)育和疾病中的調(diào)控作用
在已鑒定的170多種RNA核苷酸堿基的化學(xué)修飾中,RNA甲基化是存在于幾乎所有類型RNA上的的主要表觀轉(zhuǎn)錄修飾類型,并已被證明參與RNA代謝的整個過程,包括轉(zhuǎn)錄、 pre-mRNA可變剪切和成熟、mRNA出核、mRNA降解和穩(wěn)定、mRNA翻譯。由于高通量檢測技術(shù)發(fā)展以及動態(tài)調(diào)控因子和識別蛋白的鑒定,RNA甲基化修飾在調(diào)控生物體正常發(fā)育以及RNA甲基化失調(diào)時各種疾病發(fā)生和發(fā)育異常的機制已越來越清晰。中國科學(xué)院北京基因組研究所(國家生物信息中心)楊運桂研究員團隊以“Dynamic RNA methylation modifications and their regulatory role in mammalian development and diseases“為題發(fā)表綜述文章,特別關(guān)注三種RNA甲基化:N6-甲基胞嘧啶(m6A)、5-甲基胞嘧啶(m5C)和N7-甲基腺苷(m7G),總結(jié)了這三種RNA修飾與其動態(tài)組裝和去除、特定結(jié)合蛋白以及高通量檢測技術(shù)發(fā)展相關(guān)元件。為全面理解其生物學(xué)意義,還概述了這三種mRNA甲基化修飾在配子發(fā)生、胚胎發(fā)育、免疫系統(tǒng)發(fā)育以及疾病和腫瘤進(jìn)展中的基本機制和關(guān)鍵作用的最新知識。

mRNA的分布特征和調(diào)控元件
m6A
m6A是研究最廣泛的RNA甲基化修飾類型,幾乎存在于所有類型的RNA中,包括染色質(zhì)相關(guān)新生pre-mRNA(chromatin-associated nascent pre-mRNA,caRNA)、成熟mRNA和非編碼RNA(ncRNA)。約25%哺乳動物細(xì)胞mRNA含有m6A,每個轉(zhuǎn)錄本平均含有三個m6A殘基。利用LC-MS/MS技術(shù)鑒定出人類mRNA中m6A/A占比約0.4%–1.79%。m6A主要位于內(nèi)部mRNA中,特別是在靠近終止密碼子和mRNA的3′UTRs區(qū)域。m6A的保守motif序列是RRACH(R=A/G,H=A/C/U)。m6A的分布特征表明m6A可能廣泛參與mRNA代謝,如可變剪切、翻譯等,從而在生理和病理過程中發(fā)揮重要作用。m6A甲基化形成由甲基轉(zhuǎn)移酶(“writers”)催化,主要由METTL3、METTL14和WTAP組成,以及其他蛋白亞基,包括ZC3H13/Hakai/Virilizer、KIAA1429(VIRMA)、RBM15/15B。METTL16也是METTL同源家族蛋白之一,催化MAT2A mRNA和U6 snRNA上的m6A形成。同時m6A甲基基團能夠被去甲基化酶(“erasers”)去除,主要包括FTO和ALKBH5家族成員。m6A修飾的RNA堿基位點被特定的結(jié)合蛋白(“readers”)識別以執(zhí)行多樣的生物學(xué)功能。迄今為止已鑒定的m6A readers包括YTH結(jié)構(gòu)域蛋白(YTHDC1-2、YTHDF1-3)、核異質(zhì)核糖核蛋白(HNRNPC、HNRNPA2B1)、類胰島素生長因子2 mRNA結(jié)合蛋白(IGF2BP1-3)、真核起始因子3(eIF3)(表1)。
m5C
m5C是另一種常見且豐富的RNA修飾,存在于各種RNA中,包括mRNA、tRNA、rRNA和vtRNA。在人類和小鼠的mRNA中,m5C位于翻譯起始位點(TSS)的下游區(qū)域,通過LC-MS/MS檢測人類mRNA中m5C/C占比約為0.02%–0.09%。
與m6A類似,m5C修飾也由其“writers”和“erasers”動態(tài)調(diào)控。已經(jīng)鑒定的幾個m5C甲基轉(zhuǎn)移酶(writers),包括NOL1/NOP2/SUN結(jié)構(gòu)域家族成員(NSUN1-7)、DNA甲基轉(zhuǎn)移酶同源物(DNMT2)和特異性tRNA甲基轉(zhuǎn)移酶家族成員(TRDMT4A和TRDMT4B),其中NSUN2和NSUN6能夠催化mRNA上m5C形成。Tet家族蛋白(TET1和TET2)不僅催化DNA上5mC到5-羥甲基胞嘧啶(5hmC)的形成,還介導(dǎo)mRNA中m5C氧化。目前,有兩種主要類型的mRNA m5C readers蛋白,其具有特殊的RNA結(jié)合域,以決定m5C修飾RNA分子的不同命運,包括RNA和出口因子結(jié)合蛋白2(ALYREF)和Y-box結(jié)合蛋白(YBX1和YBX2)(表1)。
m7G
m7G也是一種普遍存在的RNA甲基化修飾,被發(fā)現(xiàn)位于真核生物的18S rRNA和tRNA變環(huán)以及microRNA(miRNA)中。此外,大多數(shù)真核mRNA在N7-鳥嘌呤的5′帽端含有m7G修飾。隨著靈敏度更高的檢測和定位技術(shù)發(fā)展,研究人員最近發(fā)現(xiàn)m7G修飾存在于mRNA內(nèi)部區(qū)域。在人類和小鼠細(xì)胞系的去帽poly(A)+ mRNA中,m7G/G占比約為0.02%–0.05%,占相同細(xì)胞中m6A/A的5%–10%(使用LC-MS/MS)。Zhang等人(2019b)報告稱,m7G峰值主要積聚區(qū)域位于3′UTR,次要區(qū)域在5′UTR內(nèi)部mRNA中。另一項報告也發(fā)現(xiàn),人類和小鼠mRNA內(nèi)部的m7G修飾富集在5′UTR,特別是在翻譯起始位點附近的AG富集區(qū)域。
與m6A和m5C相比,關(guān)于m7G調(diào)控因子的研究才剛剛開始。報道的m7G甲基轉(zhuǎn)移酶包括Trm8p/Trm82p復(fù)合體和酵母中的Bud23/Trm112,以及哺乳動物中相應(yīng)的同源物METTL1/WDR4和WBSCR22/TRMT112,其中METTL1不僅介導(dǎo)tRNA上的m7G修飾,還催化mRNA內(nèi)部m7G修飾。此外,RNMT和RAM復(fù)合體參與催化哺乳動物N7-鳥嘌呤5′帽端的m7G修飾的形成。最新研究報告稱,QKI(QKI15、QKI16和QKI17)是mRNA內(nèi)部m7G修飾的第一個reader蛋白,它在應(yīng)激條件下與G3BP1互作,抑制m7G修飾的mRNA形成應(yīng)激顆粒,同時調(diào)控Hippo信號通路中關(guān)鍵基因的穩(wěn)定性和翻譯效率(表1)。
檢測技術(shù)
基于Bulk RNA甲基化檢測技術(shù)
基于免疫沉淀方法
抗體和免疫沉淀的RNA甲基化檢測策略,是一種簡單、穩(wěn)定且低成本的方法,傳統(tǒng)上被廣泛用于各種生物的表觀轉(zhuǎn)錄組特征圖譜繪制。典型的技術(shù)分為兩類:基于RNA甲基化抗體的(包括m6A/m5C/m7G-MeRIP-seq、m6A/m7G-miCLIP-seq、PA-m6A-seq和m6A-LAIC-seq)和基于甲基轉(zhuǎn)移酶抗體的(m5C-miCLIP-Seq和AZA-IPseq)。
(1) MeRIP-seq
大多數(shù)用于RNA甲基化修飾的高通量測序技術(shù)依賴于特定甲基化抗體(如m6A、m5C和m7G)。甲基化RNA免疫沉淀測序(MeRIP-seq),如m6A-MeRIP-Seq(m6A-seq)(圖1A)、m5C-MeRIP-Seq(圖2A)和m7G-MeRIP-Seq(圖3A)是常用的方法,用于鑒定mRNA中的RNA甲基化peaks。然而,MeRIP-seq存在一些缺點,如相對較低的檢測分辨率(約100-150 nt)和對低豐度RNA上的RNA甲基化位點不敏感。Molinie等人(2016年)改進(jìn)的m6A-MeRIP-seq開發(fā)了m6A-LAIC-seq(m6A水平和異構(gòu)體特征序列),通過調(diào)整抗體使用、涉及各種內(nèi)標(biāo)調(diào)控和同時進(jìn)行上清液(m6A陰性部分)的NGS測序,計算m6A陽性和m6A陰性部分的RNA表達(dá),以在全轉(zhuǎn)錄組范圍內(nèi)定量m6A的化學(xué)計量學(xué)(表2)。
(2) miCLIP-seq
通過將MeRIP技術(shù)與光交聯(lián)反應(yīng)結(jié)合,研究人員發(fā)明了UV誘導(dǎo)的抗體-RNA交聯(lián)方法來檢測轉(zhuǎn)錄組甲基化修飾,如PA-m6A-Seq(光交聯(lián)輔助m6A測序)(圖1C)、m6A-CLIP(m6A交聯(lián)免疫沉淀)(和m6A/m7G-miCLIP(m6A/m7G甲基化單堿基分辨率交聯(lián)免疫沉淀)(圖1B和3B)。m6A-CLIP和m6A/m7G-miCLIP均基于UV交聯(lián)RNA與m6A或m7G抗體在結(jié)合位點形成共價鍵,導(dǎo)致逆轉(zhuǎn)錄過程中的C-T位點轉(zhuǎn)換或截斷,通過此方法可以準(zhǔn)確鑒定m6A位點并獲得單堿基分辨率甲基化圖譜(表2)。
(3) PA-m6A-seq
PA-m6A-seq(光交聯(lián)輔助m6A測序)方法依賴于4-硫尿苷(4SU,光敏感的核苷酸類似物)在細(xì)胞培養(yǎng)期間并入poly(A) RNA中,抗m6A免疫沉淀和UV交聯(lián),隨后進(jìn)行靶向RNA洗脫和文庫構(gòu)建(圖1C)。與MeRIP-Seq或m6A-seq相比,該方法實現(xiàn)哺乳動物接近單堿基分辨率全轉(zhuǎn)錄組m6A圖譜(表2)。
(4) m5C-miCLIP-seq
甲基轉(zhuǎn)移酶可以催化體內(nèi)特定核酸堿基位點的RNA甲基化形成。m5C甲基轉(zhuǎn)移酶NSUN2包含釋放(半胱氨酸271)和催化(半胱氨酸321)位點。m5C-miCLIP(m5C甲基化單堿基分辨率交聯(lián)和免疫沉淀)利用這一特性,通過結(jié)合細(xì)胞中外源表達(dá)的NSUN2-C271A(NSUN2上的突變釋放位點)與UV交聯(lián)免疫沉淀,其中突變蛋白NSUN2-C271A和m5C修飾位點在UV交聯(lián)下強烈結(jié)合形成共價鍵,這在RT-PCR過程中引起截斷或突變(圖2B)。因此,m5C-miCLIP也能夠以單堿基分辨率檢測m5C修飾位點(表2)。
(5) AZA-IP-seq
AZA-IP-seq(5-氮胞嘧啶介導(dǎo)的RNA免疫沉淀測序)是另一種基于甲基轉(zhuǎn)移酶抗體的m5C檢測方法。簡要來說,5-氮胞嘧啶(5-azaC),作為DNA甲基轉(zhuǎn)移酶抑制劑之一,可以隨機并入DNA和新生RNA中,并且也有能力與甲基轉(zhuǎn)移酶(外源和內(nèi)源)結(jié)合形成共價鍵。結(jié)合5-azaC處理和特定甲基轉(zhuǎn)移酶抗體(如NSUN2)的免疫沉淀,可以以單堿基分辨率檢測m5C修飾位點(圖2A,表2)。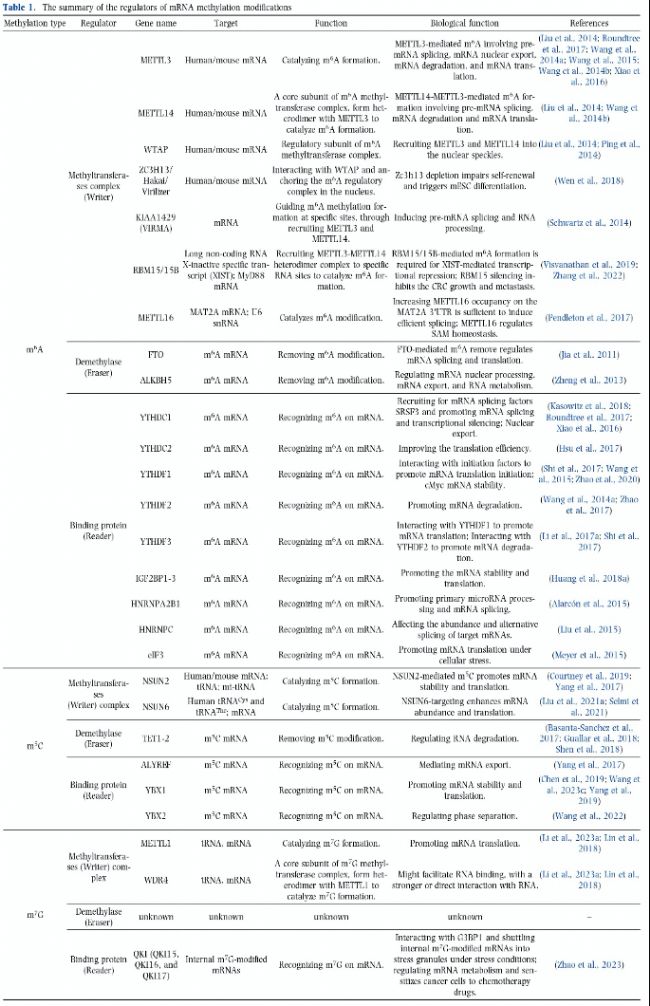
表1:mRNA甲基化修飾調(diào)控因子綜述
基于化學(xué)反應(yīng)方法
(1) RNA-BisSeq
RNA亞硫酸鹽測序(RNA-BisSeq)是定量分析mRNA m5C甲基組的經(jīng)典方法之一。它依賴于用亞硫酸鹽預(yù)處理RNA,促使未修飾的C發(fā)生化學(xué)脫氨反應(yīng)并轉(zhuǎn)化為U,而甲基化的胞嘧啶(m5C)保持為C。經(jīng)過RT、cDNA合成和PCR過程后,U堿基轉(zhuǎn)化為T,從而可以區(qū)分m5C和C。通過生物信息學(xué)分析,可以通過分析未轉(zhuǎn)化的胞嘧啶來鑒定m5C修飾位點,同時,通過計算未轉(zhuǎn)化胞嘧啶的覆蓋率百分比來估計m5C甲基化水平(圖2D)。總的來說,RNA-BisSeq不需要在細(xì)胞中表達(dá)外源基因或化學(xué)試劑,能夠準(zhǔn)確捕獲細(xì)胞和組織中原始的m5C修飾狀態(tài)。RNA-BisSeq被廣泛用于探索各種RNA中m5C的表達(dá)特征,并預(yù)測其潛在功能,包括哺乳動物、斑馬魚、擬南芥和水稻。RNA-BisSeq中m5C檢測的準(zhǔn)確性取決于亞硫酸鹽處理過程中C到U的轉(zhuǎn)化效率,這受到反應(yīng)條件(如溫度、反應(yīng)時間)和RNA狀態(tài)(如RNA質(zhì)量、RNA二級結(jié)構(gòu)等)的影響(表2)。
(2)m6A-SEAL-seq
FTO輔助的m6A選擇性化學(xué)標(biāo)記測序(m6A-SEAL-seq)是一種利用FTO作為催化劑將m6A轉(zhuǎn)化為hm6A(N6-羥甲基腺苷)的化學(xué)標(biāo)記方法。不穩(wěn)定的hm6A將通過二硫蘇糖醇(DTT)介導(dǎo)的硫醇加成化學(xué)反應(yīng)轉(zhuǎn)化為更穩(wěn)定的dm6A(N6-二硫代肌醇甲腺苷)。然后,dm6A通過甲硫磺酸鹽(MTSEA)響應(yīng)組裝生物素標(biāo)簽,隨后進(jìn)行鏈霉親和純化和測序(圖1D)。m6A-SEAL分辨率約為200 nt(表2)。
(3) m6A-label-seq
這種技術(shù)基于甲硫氨酸類似物Se-烯丙基硒代同型半胱氨酸作為人類和小鼠細(xì)胞的培養(yǎng)營養(yǎng)物質(zhì)。這種類似物可以驅(qū)動甲基供體SAM被烯丙基團標(biāo)記,通過細(xì)胞自身代謝形成Allyl-SAM或Allyl-SeAM。因此,細(xì)胞RNA能夠在假定m6A生成腺苷位點被代謝性地修飾為N6-烯丙基腺苷(a6A)。基于碘化誘導(dǎo)的a6A環(huán)化和在cDNA逆轉(zhuǎn)錄過程中對側(cè)位點錯配,實現(xiàn)全轉(zhuǎn)錄組范圍內(nèi)單堿基分辨率檢測。m6A-label-seq的建立為理解m6A在分子水平上的生理作用提供了強有力的工具,并且可以應(yīng)用于所有m6A motif。烯丙基團標(biāo)記的效率和時間窗口對于準(zhǔn)確鑒定m6A位點至關(guān)重要(表2)。
(4) m6A-SAC-seq
m6A選擇性烯丙基化學(xué)標(biāo)記和測序(m6A-SAC-seq)是單堿基分辨率繪制全轉(zhuǎn)錄組m6A圖譜方法之一。這種方法的本質(zhì)是使用Dim1/KsgA家族的二甲基轉(zhuǎn)移酶酶(MjDim1)在m6A上添加烯丙基SAM化學(xué)基團形成烯丙基6m6A,隨后在I2處理后發(fā)生環(huán)化。環(huán)化的烯丙基6m6A在逆轉(zhuǎn)錄過程中將被read為突變。根據(jù)突變reads,可以定量和分析轉(zhuǎn)錄組中m6A沉積位點(圖1F)。m6A-SAC-seq能夠覆蓋幾乎所有經(jīng)典的m6A motif,并已應(yīng)用于檢測HeLa、HEK293、HepG2以及造血干細(xì)胞(HSC)和單核細(xì)胞中的m6A水平。m6A-SAC-seq的初始樣本量約為30ng的poly(A)或rRNA耗盡RNA(表2)。
(5) GLORI
類似于RNA m5C的RNA-BisSeq,乙二醛和亞硝酸鹽介導(dǎo)的未甲基化腺苷的脫氨(GLORI)也是一種無偏倚、絕對基于化學(xué)反應(yīng)的m6A定量方法。該程序包含三個連續(xù)步驟:①使用乙二醛形成可逆結(jié)構(gòu)保護G(N1, N2-二羥基鳥嘌呤加合物)以避免亞硝酸鹽誘導(dǎo)的G脫氨;②未甲基化的A通過亞硝酸鹽催化的脫氨反應(yīng)轉(zhuǎn)化為I;③通過堿性或加熱條件處理實現(xiàn)G的脫保護(圖1G)。GLORI的主要優(yōu)勢是實現(xiàn)RNA中m6A定量分析,但GLORI成本高于m6A MeRIP-seq,且GLORI無法區(qū)分m6A和其他一些A修飾,如m6Am和m1A,盡管技術(shù)發(fā)明者聲稱已開發(fā)出分析流程來消除由m6Am和m1A引起的假陽性(表2)。
(6) eTAM-seq
進(jìn)化的TadA輔助N6-甲基腺苷測序(eTAM-seq)是一種基于酶促脫氨反應(yīng)的單堿基分辨率m6A測序方法,用于全轉(zhuǎn)錄組范圍內(nèi)定量檢測m6A位點。簡要來說,使用高活性的tRNA腺苷脫氨酶TadA8.20進(jìn)行脫氨反應(yīng),全局未甲基化的A轉(zhuǎn)化為I,只能與C配對并在隨后的逆轉(zhuǎn)錄、文庫構(gòu)建和測序過程中被讀為G。修飾的m6A保持不變,在測序過程中仍然被讀為A。因此,通過eTAM-seq,A被讀為G,m6A被讀為A。eTAM-seq能夠在極少量RNA中(低至10個細(xì)胞的RNA)進(jìn)行m6A的定量檢測,其初始RNA需求遠(yuǎn)低于現(xiàn)有的m6A定量分析方法(圖1H)。
(7) TAWO-seq
TET輔助的過鎢酸鹽氧化測序(TAWO-seq)也是一種 RNA m5C單堿基分辨率測序方法,主要包含三個連續(xù)程序,包括由β-葡萄糖轉(zhuǎn)移酶(βGT)標(biāo)記保護的原始hm5C,由TET酶氧化的原始m5C轉(zhuǎn)化為hm5C,以及由過鎢酸鹽介導(dǎo)的新生成hm5C的選擇性氧化為三羥基胸腺嘧啶(thT)(圖2E)。這項技術(shù)的最大優(yōu)勢是與RNA-BisSeq相比能夠區(qū)分m5C和hm5C。
(8) m7G-seq
m7G上的正電荷對NaBH4介導(dǎo)的還原特別敏感。m7G-seq采用NaBH4介導(dǎo)的還原,在m7G位置上產(chǎn)生一個堿性位點,然后這些位點被生物素標(biāo)記,隨后進(jìn)行生物素下拉實驗。在逆轉(zhuǎn)錄過程中,RNA中的生物素標(biāo)記m7G位點會導(dǎo)致錯配(主要是T以及其他堿基),從而實現(xiàn)基于這些突變的m7G甲基組的單堿基分辨率(圖3C,表2)。
基于酶切反應(yīng)技術(shù)
MAZTER-seq和m6A-REF-seq(m6A敏感的RNA內(nèi)切核酸酶促進(jìn)的測序)是同時報道不依賴抗體的方法,用于定量m6A的化學(xué)計量分析。這兩種方法都依賴于RNA內(nèi)切核酸酶MazF對ACA motif上的m6A識別,能夠在全轉(zhuǎn)錄組范圍內(nèi)以單堿基分辨率檢測m6A修飾位點及其豐度。MazF在mRNA上更傾向于識別A-CA motif。由于RNA上m6A的motif是RRACH(R=A/G,H=A/C/U),大多數(shù)經(jīng)過MazF酶處理后的讀段將在5'端含有ACA,因此內(nèi)部的(m6A)CA基序被認(rèn)定為甲基化位點(圖1I和J)。然而,這兩種方法都受限于內(nèi)切核酸酶對m6A CA序列的選擇性,這使得不包含m6A CA序列的序列無法被識別(表2)。
基于RNA編輯的技術(shù)
DART-seq(脫氨基作用鄰近RNA修飾靶標(biāo)測序)是一種不依賴抗體的方法,通過在哺乳動物細(xì)胞中表達(dá)外源性的APOBEC1-YTH融合蛋白來檢測全局m6A修飾位點。其中,YTH(m6A結(jié)合域)識別m6A,而連接的APOBEC1(胞嘧啶脫氨酶)直接將胞嘧啶殘基上的C編輯為U。這些編輯位點在后續(xù)的數(shù)據(jù)分析中被識別為m6A修飾區(qū)域(圖1K)。由于YTH結(jié)構(gòu)域與m6A的2'-OH之間的氫鍵鍵合是關(guān)鍵結(jié)構(gòu),DART-seq中的YTH結(jié)構(gòu)域無法識別m6Am。盡管DART-seq能夠從低量RNA(約10 ng總RNA)中繪制m6A位點,但需要將APOBEC1-YTH短暫轉(zhuǎn)染入哺乳動物細(xì)胞要求限制了其應(yīng)用,并且可能破壞了生理狀態(tài)(表2)。
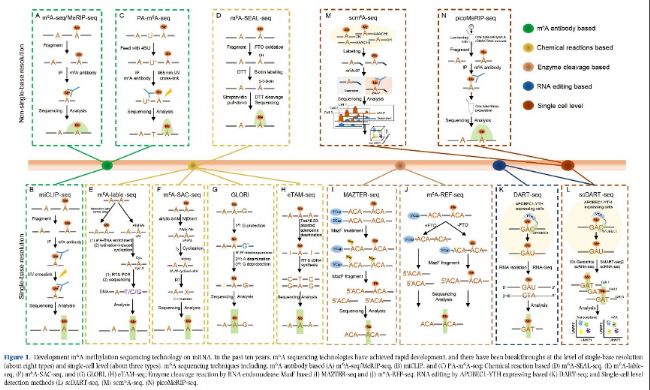
圖1:mRNA甲基化測序技術(shù)的發(fā)展。過去十年m6A測序技術(shù)取得快速發(fā)展,在單堿基分辨率(約八種類型)和單細(xì)胞水平(約三種類型)上取得了突破:包括基于m6A抗體的(A)m6A-seq/MeRIP-seq、(B)miCLIP和(C)PA-m6A-seq;基于化學(xué)反應(yīng)的(D)m6A-SEAL-seq、(E)m6A-label-seq、(F)m6A-SPAC-seq和(G)GLORI、(H)eTAM-seq。
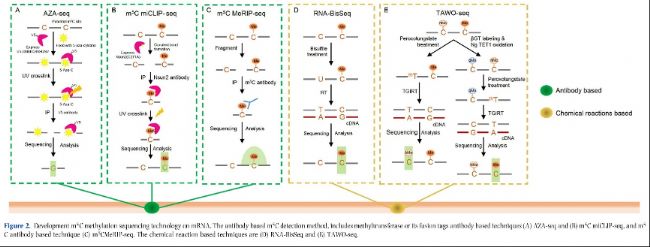
圖2:mRNA m5C甲基化測序技術(shù)。基于抗體m5C檢測方法,包括基于甲基轉(zhuǎn)移酶或其融合標(biāo)簽抗體的技術(shù)(A)AZA-seq和(B)m5C miCLIP-seq,以及基于m5C抗體的方法(C)m5C MeRIP-seq。基于化學(xué)反應(yīng)的技術(shù)是(D)RNA-BisSeq和(E)TAWO-seq。
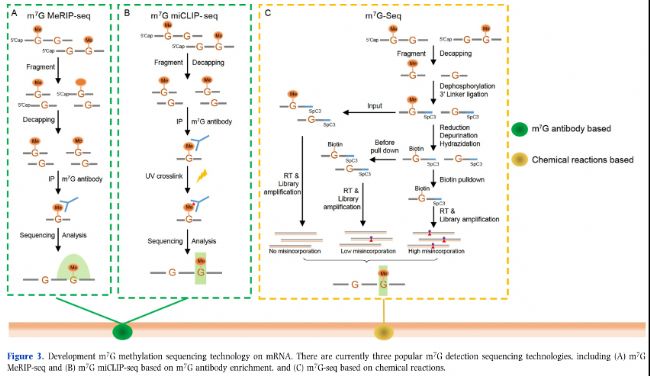 圖3:mRNA m7G甲基化測序技術(shù)。目前有三種流行的m7G檢測測序技術(shù),包括(A)m7G MeRIP-seq和(B)基于m7G抗體富集的m7G-miCLIP-seq以及(C)基于化學(xué)反應(yīng)的m7G-seq。
圖3:mRNA m7G甲基化測序技術(shù)。目前有三種流行的m7G檢測測序技術(shù),包括(A)m7G MeRIP-seq和(B)基于m7G抗體富集的m7G-miCLIP-seq以及(C)基于化學(xué)反應(yīng)的m7G-seq。
與單細(xì)胞組學(xué)圖譜相比,傳統(tǒng)的群體細(xì)胞測序方法使用的樣本包含成千上萬個細(xì)胞,因此只能反映群體中的平均甲基化水平。特別是,細(xì)胞表達(dá)的異質(zhì)性在很大程度上被掩蓋,無法準(zhǔn)確反映組織/器官的真實生理或病理特征。目前已經(jīng)建立單細(xì)胞水平的測序技術(shù),用于繪制轉(zhuǎn)錄組、染色質(zhì)開放可及性、DNA甲基化修飾等圖譜。報道的單細(xì)胞轉(zhuǎn)錄組甲基化圖譜技術(shù)包括scDART-seq和scm6A-seq。
(1) scDART-seq
scDART-seq是在引入10X Genomics單細(xì)胞測序后從DART-seq發(fā)展而來,是首個單細(xì)胞水平的m6A檢測方法。通過應(yīng)用scDART-seq,在成千上萬個單細(xì)胞中進(jìn)行m6A圖譜分析,發(fā)現(xiàn)m6A在單細(xì)胞水平上表現(xiàn)出高度異質(zhì)性,并且可以根據(jù)RNA甲基化特征區(qū)分細(xì)胞亞群,與基因表達(dá)水平無關(guān)。這些發(fā)現(xiàn)揭示以前在bulk-cell m6A分析中被忽視的m6A基本特征,并為理解m6A在不同細(xì)胞中的功能提供新見解(圖1L)。但由于scDART-seq基于外源基因表達(dá),因此很難應(yīng)用于組織樣本,也無法呈現(xiàn)細(xì)胞的原始狀態(tài)(表2)。
(2) scm6A-seq
通過結(jié)合RNA多重標(biāo)記和MeRIP-seq/m6A-IP,scm6A-seq能夠捕獲全轉(zhuǎn)錄組范圍的m6A圖譜,并能夠在不表達(dá)任何外源基因的情況下比較單細(xì)胞中的m6A水平。它已被用于區(qū)分有核仁包圍(SN)和無核仁包圍(NSN)的卵母細(xì)胞,以單細(xì)胞分辨率繪制小鼠卵母細(xì)胞發(fā)育和合子基因組激活期間的m6A調(diào)控機制(圖1M,表2)。
(3) picoMeRIP-seq
picoMeRIP-seq也是一種基于m6A抗體的低輸入RNA/細(xì)胞或單細(xì)胞啟動的m6A圖譜方法。與scm6A-seq相比,picoMeRIP-seq不標(biāo)記單細(xì)胞中的RNA,后續(xù)文庫構(gòu)建直接使用商業(yè)的SMART-Seq stranded kit(TaKaRa)。在這種方法中,通過系統(tǒng)優(yōu)化關(guān)鍵步驟提高了m6A/A富集比率,包括增加洗滌劑(SDS)和鹽(NaCl)濃度,使用低結(jié)合管和商業(yè)m6A抗體(Millipore)等(圖1N)。picoMeRIP-seq已用于在100 pg poly(A) RNA、單個斑馬魚合子、單個小鼠卵母細(xì)胞和植入前胚胎、小鼠胚胎干細(xì)胞(1,000、100和10個細(xì)胞)的全轉(zhuǎn)錄組水平上繪制m6A(表2)。
綜上所述,過去十年中RNA甲基化測序技術(shù)的快速發(fā)展使我們能夠更清晰地了解RNA甲基化修飾的分布特征和功能機制。盡管每種技術(shù)都有其自身的優(yōu)勢和劣勢,但它們可以從多個維度進(jìn)行補償或校正,以獲得更準(zhǔn)確的RNA甲基化位點信息。此外,在單堿基精度和單細(xì)胞水平上取得了技術(shù)突破,這可以更精細(xì)地捕獲細(xì)胞間RNA甲基化的異質(zhì)性,并建立單細(xì)胞水平的RNA甲基化調(diào)控網(wǎng)絡(luò)。
生物學(xué)功能
RNA過程和代謝
作為轉(zhuǎn)錄后修飾,RNA甲基化參與RNA代謝的整個過程,如pre-mRNA剪切、mRNA出核、mRNA降解或穩(wěn)定性以及mRNA翻譯。
pre-mRNA剪切
pre-mRNA剪切作為基因表達(dá)轉(zhuǎn)錄后調(diào)控的第一階段,是去除pre-mRNA中內(nèi)含子、有序連接外顯子以最終生成成熟mRNA的過程。pre-mRNA可變剪切是這一過程中的關(guān)鍵步驟,它可以從一個基因生成多個轉(zhuǎn)錄本,為遺傳多樣性和復(fù)雜性做出貢獻(xiàn)。m6A去甲基化酶(FTO和ALKBH5)和甲基轉(zhuǎn)移酶復(fù)合體(WTAP、METTL3和METTL14)定位于核斑點中,提示m6A在RNA剪切中的潛在作用。FTO優(yōu)先結(jié)合內(nèi)含子區(qū)域pre-mRNA,靠近可變剪切(AS)外顯子和聚腺苷酸位點,并調(diào)控可變剪切和3′UTR表達(dá)。
m6A reader蛋白hnRNPG結(jié)合到共轉(zhuǎn)錄新生的m6A修飾pre-mRNA,并通過對RNA聚合酶II的互作及其在hnRNPG調(diào)控外顯子周圍的占位影響來調(diào)控可變剪切。此外,m6A分布在圍繞5′-和3′-剪切位點的外顯子區(qū)域,并與SRSF1和SRSF2的結(jié)合簇空間重疊。在3T3-L1細(xì)胞中敲除FTO增強了m6A水平,并促進(jìn)了SRSF2蛋白的RNA結(jié)合能力,該蛋白調(diào)控脂肪生成調(diào)控因子RUNX1T1的可變剪切和隨后的前脂肪細(xì)胞分化。同時,有報道稱m6A參與依賴其閱讀蛋白YTHDC1的pre-mRNA剪切,促進(jìn)pre-mRNA剪切因子SRSF3(SRp20)而阻止SRSF10(SRp38)進(jìn)入目標(biāo)mRNA的結(jié)合區(qū)域。小鼠卵母細(xì)胞中的Ythdc1與pre-mRNA 3′端處理因子(CPSF6、SRSF3和SRSF7)互作,并以m6A依賴方式廣泛參與可變聚腺苷酸化和改變3′UTR長度。果蠅中YTH家族蛋白的同源物YT521-B介導(dǎo)依賴于m6A的pre-mRNA可變剪切,并調(diào)控果蠅的神經(jīng)功能和性別決定。Louloupi等人報告稱,剪切位點上的m6A沉積促進(jìn)快速剪切,而內(nèi)含子中高m6A水平與慢可變剪切相關(guān)。有趣的是,m6A開關(guān)調(diào)控HNRNPC結(jié)合活性,其中m6A主導(dǎo)RNA和reader蛋白互作的RNA結(jié)構(gòu)依賴性可及性,促進(jìn)外顯子保守并影響目標(biāo)mRNA的可變剪切。總的來說,m6A對pre-mRNA成熟過程發(fā)揮重要作用,但m5C或m7G是否也參與這一過程尚不清楚。
mRNA出核
mRNA出核是基因表達(dá)過程中的關(guān)鍵步驟,mRNA通過這一步驟被轉(zhuǎn)運到細(xì)胞質(zhì)中進(jìn)行翻譯。大多數(shù)mRNA出核依賴于轉(zhuǎn)錄出核復(fù)合體(TREX)和核異二聚體出核受體(NXF1-P15)通路,其中TREX復(fù)合體成員被沉積在mRNA上并將其交給NXF1。
YTHDC1通過剪切因子SRSF3和出核接頭NXF1促進(jìn)含m6A的mRNA出核。研究發(fā)現(xiàn)多個TREX亞基(ALYREF、UAP56、THOC5、CHTOP)與m6A甲基轉(zhuǎn)移酶復(fù)合體(WTAP、METTL3、METTL14、KIAA1429)互作,調(diào)控轉(zhuǎn)錄本出核。Mettl3在細(xì)胞核中顯著增加了時鐘基因Per2和Arntl的mRNA積累,而細(xì)胞中ALKBH5缺失加速了mRNA的RNA出核。同時,HeLa細(xì)胞中YTHDC1缺失導(dǎo)致m6A修飾的mRNA核積聚,而在細(xì)胞質(zhì)中缺失。
除了m6A,m5C也在mRNA出核中發(fā)揮關(guān)鍵作用。ALYREF不僅是m5C reader蛋白,也是調(diào)控核質(zhì)穿梭的TREX亞基之一。在HeLa細(xì)胞中,ALYREF促進(jìn)含m5C的mRNA出核。3T3-L1細(xì)胞中NSUN2的缺乏導(dǎo)致ALYREF-m5C軸介導(dǎo)的CDKN1A mRNA出核減少,導(dǎo)致細(xì)胞周期加速和促進(jìn)脂肪形成。
mRNA降解和穩(wěn)定性
m6A修飾參與調(diào)控mRNA代謝。在野生型mESCs中,Mettl3和Mettl14組成的甲基轉(zhuǎn)移酶復(fù)合體在標(biāo)靶轉(zhuǎn)錄本上催化m6A形成,隨后阻止與mRNA穩(wěn)定性相關(guān)蛋白HuR的結(jié)合,并增強microRNA靶點,導(dǎo)致目標(biāo)轉(zhuǎn)錄本不穩(wěn)定。YTHDF2是一個經(jīng)典的m6A reader蛋白,它通過多種通路促進(jìn)含有m6A的靶轉(zhuǎn)錄本降解。首先,Wang等人(2014a)分析了YTHDF2蛋白結(jié)構(gòu),發(fā)現(xiàn)YTHDF2的羧基末端域(C-YTHDF2)選擇性地識別含m6A mRNA,而氨基末端域(N-YTHDF2)負(fù)責(zé)將YTHDF2-m6A-mRNA復(fù)合體定位到更專門的mRNA降解機器(如P體等)。其次,哺乳動物細(xì)胞中的YTHDF2招募CCR4-NOT脫腺苷酸酶復(fù)合體,加速含m6A RNA的脫腺苷酸化和降解。此外,YTHDF2還與HRSP12互作,招募RNase P/MRP復(fù)合體(內(nèi)切核糖核蛋白酶復(fù)合體),以切割含m6A的RNA。YTHDF2介導(dǎo)的m6A甲基化mRNA的降解在各種發(fā)育和疾病過程中發(fā)揮關(guān)鍵作用,如維持造血干細(xì)胞功能、在卵母細(xì)胞成熟和胚胎發(fā)生過程中母源mRNA降解、癌癥進(jìn)展等。
與YTHDF2作用不同,另一個m6A reader蛋白IGF2BPs參與維持穩(wěn)定性和儲存,并在正常和應(yīng)激條件下影響目標(biāo)m6A甲基化mRNA基因表達(dá)。IGF2BPs介導(dǎo)的m6A修飾mRNA的穩(wěn)定性參與腫瘤形成。
m5C修飾在mRNA穩(wěn)定性中也表現(xiàn)出類似的作用。兩項平行研究報告稱,m5C reader蛋白YBX1通過招募RNA穩(wěn)定性相關(guān)蛋白(HuR或PABPC1a)影響目標(biāo)mRNA穩(wěn)定性,并因此參與膀胱尿路上皮癌(UCB)的腫瘤形成和轉(zhuǎn)移,以及斑馬魚胚胎發(fā)育。在小鼠Th17細(xì)胞中NSUN2缺失以m5C依賴方式導(dǎo)致Il17a和Il17f mRNAs的半衰期和數(shù)量減少。
翻譯
RNA甲基化已被證明可以促進(jìn)或抑制翻譯過程。在細(xì)胞質(zhì)中,YTHDF1富集在40S核糖體的蛋白質(zhì)亞基中,并與翻譯啟動復(fù)合體的組成部分eIF3互作,從而促進(jìn)m6A依賴的mRNA翻譯。
YTHDF3也與YTHDF1協(xié)同促進(jìn)蛋白質(zhì)合成。另一項平行研究也報告稱,YTHDF3與YTHDF1合作,通過在翻譯過程中順序招募翻譯效應(yīng)物(40S和60S核糖體亞基)來促進(jìn)m6A修飾目標(biāo)mRNA的翻譯效率。總體而言,YTHDF1和YTHDF3通過與YTHDF1/YTHDF3鏈接,在轉(zhuǎn)錄本m6A修飾的3'端和40S和60S亞基的翻譯效應(yīng)物的5'端之間形成loop,調(diào)控翻譯啟動。最近的報告還說明了幾條分子通路參與YTHDF1或YTHDF3介導(dǎo)的m6A修飾轉(zhuǎn)錄本的翻譯過程。Zou等人(2023年)報告稱,YTHDF1與核糖體蛋白結(jié)合以促進(jìn)其目標(biāo)mRNA翻譯,但FMRP通過阻礙YTHDF1與核糖體蛋白的結(jié)合來抑制神經(jīng)翻譯。然而在神經(jīng)刺激下,F(xiàn)MRP被磷酸化并釋放YTHDF1,以提高m6A甲基化mRNA翻譯效率,從而促進(jìn)神經(jīng)去極化。同時,Chen等人(2023年)已經(jīng)證明YTHDF1和YTHDF3(不是YTHDF2)攜帶高水平的營養(yǎng)感應(yīng)O-GlcNAc修飾,O-GlcNAcylation通過抑制它們與mRNA翻譯相關(guān)蛋白互作,抑制YTHDF1和YTHDF3的翻譯促進(jìn)功能,導(dǎo)致m6A甲基化mRNA翻譯抑制。Chen等人(2023年)還建議不同的細(xì)胞在YTHDF1/3上表現(xiàn)出不同的O-GlcNAc修飾水平,這可能是先前研究對YTHDF1/3是否促進(jìn)m6A RNA翻譯功能得出不同結(jié)論的原因之一。此外,當(dāng)m6A位于5'UTR時,它可以通過被43S復(fù)合體組分eIF3識別,在細(xì)胞應(yīng)激下促進(jìn)帽的單獨翻譯。另一個reader蛋白YTHDC2也以m6A依賴方式增強其靶標(biāo)翻譯效率。盡管如此,Choi等人(2016年)證明,轉(zhuǎn)錄本中m6A修飾密碼子通過破壞轉(zhuǎn)錄本上tRNA的選擇導(dǎo)致翻譯延伸動態(tài)更慢和翻譯效率更低。此外,Lin等人(2016年)發(fā)現(xiàn)METTL3,而不依賴其m6A催化活性,通過招募eIF3到翻譯啟動復(fù)合體,增強包括重要的癌基因如EGFR和TAZ在內(nèi)的目標(biāo)mRNA翻譯,導(dǎo)致人類肺癌細(xì)胞的生長、存活和侵襲得到促進(jìn)。
m5C廣泛分布在rRNA和tRNA變區(qū)和反密碼loop上,通過調(diào)控tRNA穩(wěn)定性和密碼子識別、翻譯保真度和準(zhǔn)確性或全局蛋白質(zhì)合成等參與翻譯調(diào)控。mRNA上的m5C也參與調(diào)控翻譯效率,在3T3-L1細(xì)胞中,NSUN2以m5C依賴的方式促進(jìn)CDKN1A mRNA的翻譯效率。在大鼠的T淋巴細(xì)胞中,NSun2介導(dǎo)的m5C修飾在高同型半胱氨酸血癥誘導(dǎo)下促進(jìn)IL-17A mRNA的翻譯。此外,NSUN6特異性m5C位點富集在3'UTR中的CTCCA motif上,與翻譯終止保真相關(guān)。然而,Tang等人(2015年)報告稱NSun2通過在p27 mRNA的5'UTR上的胞嘧啶C64上甲基化,抑制p27翻譯,表明mRNA上m5C位點可能決定其對翻譯效率的調(diào)控效應(yīng)。
真核mRNA的5'帽上m7G已被證明參與翻譯調(diào)控。最近的研究還表明,mRNA內(nèi)部的m7G修飾在mRNA翻譯通路中起作用。METTL1組裝的內(nèi)部m7G修飾能夠促進(jìn)m7G修飾轉(zhuǎn)錄本翻譯效率,而不依賴于其對全局翻譯和tRNA甲基化的影響。內(nèi)部m7G在人類mRNA沿的表現(xiàn)顯示在翻譯起始位點保守富集,而在H2O2或熱休克處理下在CDS和3'UTR區(qū)域顯著積累,促進(jìn)mRNA翻譯效率。此外,METTL1介導(dǎo)的m7G甲基化增強VEGFA mRNA翻譯,促進(jìn)人臍靜脈內(nèi)皮細(xì)胞(HUVECs)的血管生成。
綜上所述,RNA甲基化修飾在包括pre-RNA處理、mRNA代謝和翻譯在內(nèi)的整個mRNA表達(dá)過程中發(fā)揮重要作用,凸顯其生物學(xué)意義。Li等人(2017c)證明METTL3/METTL14介導(dǎo)的m6A和NSUN2介導(dǎo)的m5C甲基化在p21 3'UTR中協(xié)同增強p21翻譯,在氧化應(yīng)激誘導(dǎo)的細(xì)胞衰老中導(dǎo)致p21表達(dá)升高,表明多種RNA甲基化修飾可能協(xié)同調(diào)控同一生物學(xué)事件。然而,仍然需要揭示這些修飾單獨或協(xié)同調(diào)控mRNA表達(dá)過程的更多調(diào)控機制,這將有助于描繪多種RNA甲基化的調(diào)控網(wǎng)絡(luò)。
哺乳動物發(fā)育
配子發(fā)生
一系列最新研究表明,RNA甲基化表觀轉(zhuǎn)錄組在精子發(fā)生和卵子發(fā)生中扮演著至關(guān)重要的角色。Guo等人(2022年)通過LC-MS/MS分析發(fā)現(xiàn),多種RNA修飾(如m5C、m3C、m7G、m2G、m22G、m1G和m1A)分布在人類精子的RNA中,這些修飾在弱精子癥(AZS)和畸精子癥(TZS)組中的水平顯著高于正常精子癥(NZS)組,特別是在TZS組中m5C和m6A的水平更高。在精子發(fā)生過程中,m6A作為一個重要的調(diào)控因子,參與哺乳動物精原細(xì)胞的有絲分裂、減數(shù)分裂和精子形成。Mettl3介導(dǎo)的m6A調(diào)控精原干細(xì)胞(SSCs)的增殖和分化,并影響減數(shù)分裂的啟動。在雄性生殖細(xì)胞中敲除METTL3或METTL14會導(dǎo)致睪丸組織中SSCs快速耗竭甚至完全缺失。人類精子中METTL3上調(diào)導(dǎo)致m6A水平增加,進(jìn)而增強精子運動能力,這是弱精子癥的一個風(fēng)險因素。此外,小鼠支持細(xì)胞特異性敲除Wtap會損害SSCs的自我更新和增殖能力,最終導(dǎo)致不育,通過干擾Wtap介導(dǎo)的m6A修飾基因的可變剪切。此外,ALKBH5介導(dǎo)的小鼠精原細(xì)胞和圓形精子細(xì)胞核中的m6A參與正確剪切和較長3'UTR mRNAs生成,這是精子發(fā)生的晚期減數(shù)分裂和單倍體階段所必需的。敲除FTO會導(dǎo)致GC-1精原細(xì)胞系的染色體不穩(wěn)定和G2/M階段轉(zhuǎn)換抑制。在小鼠中,Ythdc2在雄性或雌性生殖細(xì)胞中敲除導(dǎo)致異常的配子減數(shù)分裂,導(dǎo)致不育和睪丸及卵巢體積減小。同時,小鼠減數(shù)分裂細(xì)胞中條件性敲除Ythdc2導(dǎo)致轉(zhuǎn)錄組嚴(yán)重失調(diào),包括編碼微管網(wǎng)絡(luò)蛋白的轉(zhuǎn)錄本,并導(dǎo)致減數(shù)分裂細(xì)胞和精原細(xì)胞在晚期減數(shù)分裂階段的端粒聚集和凋亡。成年雄性小鼠Ythdc1缺陷導(dǎo)致缺乏任何生殖細(xì)胞,包括有絲分裂精原細(xì)胞,并表現(xiàn)出僅支持細(xì)胞的表型。在小鼠精原細(xì)胞中敲除Ythdf2通過m6A/mRNA降解通路下調(diào)基質(zhì)金屬蛋白酶表達(dá),并影響細(xì)胞粘附和精原細(xì)胞增殖。此外,敲除m5C甲基轉(zhuǎn)移酶NSun2對精原干細(xì)胞和支持細(xì)胞沒有影響,但抑制了生殖細(xì)胞進(jìn)入減數(shù)分裂的減數(shù)分裂階段。
在卵子發(fā)生過程中,METTL3介導(dǎo)的m6A通過促進(jìn)母源mRNA翻譯效率對小鼠卵母細(xì)胞成熟是必需的。在卵母細(xì)胞的生殖泡(GV)階段敲低Mettl3嚴(yán)重抑制卵母細(xì)胞的減數(shù)分裂成熟。同時,Yao等人(2023年)證明METTL3催化的m6A沉積促進(jìn)了GV期卵母細(xì)胞中m6A修飾RNA降解。然而,Mu等人(2021年)報告稱METTL3靶向Itsn2進(jìn)行m6A修飾,隨后增強其在GV階段的穩(wěn)定性,以促進(jìn)卵母細(xì)胞發(fā)育過程中減數(shù)分裂的恢復(fù)。此外,母源YTHDF2負(fù)責(zé)以m6A依賴方式指導(dǎo)適當(dāng)?shù)哪冈崔D(zhuǎn)錄本劑量,從而決定哺乳動物卵母細(xì)胞質(zhì)量和雌性生育能力。卵母細(xì)胞中Ythdc1缺陷導(dǎo)致m6A依賴的可變剪切缺陷,導(dǎo)致卵母細(xì)胞成熟停滯和雌性不孕。在卵母細(xì)胞中特異性敲除KIAA1429導(dǎo)致GV期卵母細(xì)胞中m6A修飾RNA的異常代謝,導(dǎo)致GV卵母細(xì)胞無法進(jìn)行生殖泡破裂(GVBD)和隨后失去恢復(fù)減數(shù)分裂能力。此外,卵巢中Nsun5缺失導(dǎo)致m5C在mRNA外顯子和3'UTR區(qū)域的時間依賴性下降,影響減數(shù)分裂阻滯缺陷2樣2(MAD2L2)的mRNA穩(wěn)定性、生長分化因子9(GDF9)的翻譯效率、以及Brd8外顯子區(qū)域的異常可變剪切,導(dǎo)致卵泡發(fā)育和卵巢功能障礙。有趣的是,NSUN2在人類和小鼠MI/MII期卵母細(xì)胞的細(xì)胞質(zhì)中表達(dá),可能促進(jìn)NSUN2蛋白與母源mRNAs互作,并催化m5C形成。卵母細(xì)胞中m5C修飾轉(zhuǎn)錄本的逐漸增加和沉積可能在早期胚胎發(fā)生中起作用。
早期胚胎發(fā)育
RNA甲基化修飾在胚胎發(fā)育中發(fā)揮重要作用。在體外,小鼠GV期卵母細(xì)胞中METTL3缺失會阻礙受精后胚胎發(fā)育中的母系到合子轉(zhuǎn)變(MZT)和合子基因組激活,可能是通過破壞母源mRNA降解。小鼠胚胎4細(xì)胞階段的轉(zhuǎn)錄因子mRNA上,如Cdx2、Nanog、Sox2和Pou5f1的m6A修飾,可能參與調(diào)控合子基因激活(ZGA)過程。m6A reader蛋白YTHDF2在母源上是必需的,對于卵母細(xì)胞的能力和早期MZT過程,具有清除m6A修飾的母源mRNA作用。由METTL3依賴的m6A甲基化調(diào)控的HnRNPA2/B1在著床前胚胎發(fā)育期間在核和細(xì)胞質(zhì)中表達(dá),其功能缺陷會延緩4細(xì)胞階段后的胚胎發(fā)育,并通過對胚泡中多能性的調(diào)控影響內(nèi)細(xì)胞團(ICM)的形成。斑馬魚胚胎發(fā)生中的m5C reader蛋白YBX1招募Pabpc1a來維持m5C修飾的母源mRNA穩(wěn)定性,促進(jìn)有序的MZT過程。
對于小鼠胚胎干細(xì)胞(mESC),Wang等人報告稱m6A甲基化對于維持mESC在其基礎(chǔ)狀態(tài)至關(guān)重要,Mettl3或Mettl14缺失會導(dǎo)致mESC失去自我更新能力,這是由于HuR-microRNA和m6A介導(dǎo)的RNA穩(wěn)定性通路功能障礙。Zc3h13靶向核中的WTAP、Virilizer和Hakai的成分復(fù)合體上,催化m6A形成,然后促進(jìn)mESC自我更新。Batista等人(2014年)證明小鼠和人類ESC中Mettl3缺失降低了m6A修飾水平,延長分化時Nanog表達(dá),導(dǎo)致促進(jìn)mESC自我更新和抑制mESC分化。此外,Mettl3介導(dǎo)的m6A甲基化維持多能性因子保真和及時下調(diào),調(diào)控小鼠原始多能性解決過程中適當(dāng)?shù)淖V系啟動和分化。Mettl14介導(dǎo)的m6A調(diào)控mRNA表達(dá)和可變剪切,并進(jìn)一步轉(zhuǎn)換為原始多能性到啟動多能性和外胚層分化的小鼠胚胎。更重要的是,METTL14缺失在E6.5和E7.5(胚胎日)導(dǎo)致嚴(yán)重的生長遲緩和異常形態(tài)。
免疫系統(tǒng)發(fā)育
免疫細(xì)胞起源于造血干細(xì)胞(HSCs)分化,其命運對整個免疫系統(tǒng)至關(guān)重要。越來越多的證據(jù)支持RNA甲基化從多個角度調(diào)控HSCs。斑馬魚胚胎中Mettl3缺失抑制了最早的HSPCs生成,通過破壞YTHDF2介導(dǎo)的動脈內(nèi)皮基因 notch1a 和 rhoca 的m6A依賴性mRNA衰變。與斑馬魚中的功能一致,Mettl3-m6A-YTHDF2-Notch軸通路在小鼠HSPCs生成和明確的造血中也顯示出不可或缺和保守的功能。小鼠中階段特異性的Mettl3缺失導(dǎo)致HSCs積累,并因未能通過METTL3介導(dǎo)的m6A甲基化上調(diào)MYC表達(dá)而阻止HSC分化。Cheng等人(2019b)還證明m6A通過調(diào)控MYC mRNA穩(wěn)定性維持HSC對稱。同時METTL14在正常髓系造血過程中表達(dá)下調(diào),并通過正向調(diào)控MYB和MYC mRNA穩(wěn)定性和翻譯,基于m6A方式促進(jìn)HSPCs向髓系細(xì)胞分化。Ythdf2缺失通過促進(jìn)與干細(xì)胞自我更新相關(guān)的轉(zhuǎn)錄因子m6A介導(dǎo)的mRNA穩(wěn)定性,促進(jìn)HSPCs和人類臍帶血(hUCB)HSCs擴增。Mapperley等人(2021年)還報告稱,造血特異性Ythdf2缺失導(dǎo)致m6A修飾和炎癥反應(yīng)相關(guān)轉(zhuǎn)錄本上調(diào),并激活促炎通路,導(dǎo)致淋巴潛能喪失,隨后髓系偏向和HSC擴增。并且老化的Ythdf2缺失HSCs導(dǎo)致多系造血重建失敗。
RNA甲基化通過調(diào)控免疫相關(guān)基因的轉(zhuǎn)錄本代謝參與先天免疫。在巨噬細(xì)胞中,SOCS1作為SOCS家族蛋白之一,參與巨噬細(xì)胞激活的負(fù)反饋回路,通過促進(jìn)目標(biāo)信號蛋白的多泛素化和蛋白酶體降解,以防止壓倒性的全身炎癥,其在巨噬細(xì)胞中對感染的響應(yīng)依賴于METTL14-m6A-YTHDF1軸。METTL3缺失導(dǎo)致m6A介導(dǎo)的mRNA穩(wěn)定性和Irakm高表達(dá),最終抑制TLR(Toll樣受體)信號介導(dǎo)的巨噬細(xì)胞激活。樹突狀細(xì)胞(DCs)作為連接先天和適應(yīng)性免疫反應(yīng)的專業(yè)抗原呈遞細(xì)胞(APCs),對啟動適應(yīng)性免疫反應(yīng)、消除入侵病原體和維持免疫穩(wěn)態(tài)至關(guān)重要。Mettl3催化的mRNA m6A甲基化增強了CD40、CD80和TLR4信號接頭Tirap翻譯,并促進(jìn)DC激活和TLR4/NF-κB信號誘導(dǎo)的細(xì)胞因子產(chǎn)生。此外,NK細(xì)胞中的Ythdf2對IL-15/STAT5信號介導(dǎo)的NK細(xì)胞存活、增殖和效應(yīng)功能是必需的,促進(jìn)NK細(xì)胞的抗腫瘤和抗病毒免疫活性。小鼠腫瘤模型中Mettl3缺失下調(diào)m6A甲基化基因SHP-2表達(dá),可能導(dǎo)致NK細(xì)胞對IL-15刺激應(yīng)答降低,并抑制NK細(xì)胞在腫瘤微環(huán)境中的浸潤和功能。
除了先天免疫,RNA甲基化還參與調(diào)控適應(yīng)性免疫反應(yīng)。Mettl3介導(dǎo)SOCS家族蛋白SOCS1、SOCS3和CISH的m6A形成及其隨后的降解,降低了SOCS家族活性,從而促進(jìn)IL-7介導(dǎo)的STAT5激活和naïve T細(xì)胞的穩(wěn)態(tài)增殖和分化。在Tregs中敲除Mettl3/m6A增加了Socs mRNA表達(dá),從而抑制IL-2-STAT5信號通路,維持Tregs抑制功能。Th17細(xì)胞敲除METTL3可以促進(jìn)SOCS3 mRNA穩(wěn)定性,從而抑制IL-17A和CCR5表達(dá),破壞Th17細(xì)胞分化和浸潤。METTL3介導(dǎo)的m6A穩(wěn)定Tcf7轉(zhuǎn)錄本,允許正常產(chǎn)生TCF-1蛋白及其調(diào)控的T濾泡輔助(Tfh)細(xì)胞調(diào)控因子,促進(jìn)了Tfh細(xì)胞分化、增殖和功能成熟。T細(xì)胞特異性敲除ALKBH5增強了CD4+ T細(xì)胞中m6A修飾水平,并下調(diào)Cxcl2和Ifng的mRNA穩(wěn)定性和蛋白表達(dá),導(dǎo)致CD4+ T細(xì)胞功能和中性粒細(xì)胞招募在自身免疫期間受到抑制。
與m6A相比,關(guān)于其他RNA甲基化修飾在免疫細(xì)胞中的功能機制的研究相對較少。在高同型半胱氨酸血癥(HHcy)誘導(dǎo)的大鼠慢性炎癥疾病模型中,NSun2通過催化m5C形成及其在T淋巴細(xì)胞中促進(jìn)翻譯來介導(dǎo)IL-17A表達(dá)上調(diào)。Yang等人(2023年)還發(fā)現(xiàn)NSun2特別與Th17細(xì)胞轉(zhuǎn)錄因子RoRγt結(jié)合,催化其靶標(biāo)上的RNA m5C形成,包括Il17a和Il17f,從而增強其mRNA穩(wěn)定性。小鼠CD4+ T細(xì)胞中Nsun2缺失特別抑制了Th17細(xì)胞分化,并緩解Th17細(xì)胞誘導(dǎo)的結(jié)腸炎發(fā)病機制。在系統(tǒng)性紅斑狼瘡(SLE)患者的CD4+ T細(xì)胞中,Nsun2表達(dá)和m5C修飾水平下調(diào),高甲基化m5C轉(zhuǎn)錄本主要參與mRNA剪切、穩(wěn)定和翻譯的細(xì)胞因子相關(guān)信號通路,而低甲基化m5C轉(zhuǎn)錄本主要參與翻譯延伸。
總的來說,RNA甲基化修飾廣泛參與生物體的發(fā)育過程,并在配子發(fā)生、胚胎發(fā)生以及胚胎后神經(jīng)和免疫系統(tǒng)發(fā)育等多個功能通路中發(fā)揮關(guān)鍵作用。目前,m6A在發(fā)育研究中的關(guān)注度比其他修飾更多。隨著檢測技術(shù)的進(jìn)步和各種RNA甲基化調(diào)控因子的鑒定,其他甲基化修飾在發(fā)育中的功能分析也可能變得有價值。
癌癥
目前,已有數(shù)百項研究證明RNA甲基化通過直接作用或其調(diào)控元件參與包括癌癥在內(nèi)的多種疾病發(fā)生和發(fā)展的調(diào)控。以下僅總結(jié)一些最新的(過去五年)和尖端的關(guān)于腫瘤發(fā)生中RNA甲基化修飾的研究。越來越多的證據(jù)表明m6A失調(diào)驅(qū)動異常的轉(zhuǎn)錄和翻譯程序,并隨后促進(jìn)疾病或腫瘤的發(fā)生和進(jìn)展,如白血病、肝細(xì)胞癌(HCC)、肺癌(LC)、結(jié)直腸癌(CRC)、乳腺癌、膀胱癌(BC)、胰腺癌(PC)、胃癌(GC)、膠質(zhì)母細(xì)胞瘤。m6A在癌細(xì)胞代謝中發(fā)揮重要作用,包括通過調(diào)控代謝相關(guān)通路,如mTOR、PTEN、MAPK、NF-κB、Wnt信號通路等,或轉(zhuǎn)錄因子,如HIF-1、FOXM1、cMyc、YAP。m6A還參與重塑各種腫瘤免疫,通過調(diào)控免疫細(xì)胞的生存或功能,包括B細(xì)胞、CD8+ T細(xì)胞、CD4+ T細(xì)胞、PD-1+ T細(xì)胞、Treg細(xì)胞、NK細(xì)胞、DC細(xì)胞、巨噬細(xì)胞、中性粒細(xì)胞、嗜酸性粒細(xì)胞和CD4+記憶激活T細(xì)胞的浸潤,以及免疫相關(guān)細(xì)胞因子的表達(dá),如FN-γ、CXCL9和CXCL10。總體而言,m6A影響腫瘤發(fā)生和轉(zhuǎn)移、代謝、免疫逃逸,在診斷和治療方面具有潛在價值。
m5C調(diào)控因子,如NSUN2的甲基轉(zhuǎn)移酶和YBX1的reader蛋白,在腫瘤組織中高表達(dá)。m5Cs在腫瘤組織中也經(jīng)常出現(xiàn)高甲基化,并在致癌通路中富集。NSUN2和YBX1在UCB中靶向HDGF基因3'UTR的m5C,調(diào)控HDGF mRNA穩(wěn)定性并促進(jìn)UCB發(fā)病機制。丙酮酸激酶肌肉同工酶M2(PKM2),作為一種限速的糖酵解酶,參與腫瘤代謝和生長,其mRNA的3'UTR含有m5C位點。ALYREF直接識別PKM2 mRNA并以其m5C依賴性方式促進(jìn)其穩(wěn)定性,從而促進(jìn)糖酵解和膀胱癌的腫瘤發(fā)生。類似的研究還表明,NSUN2介導(dǎo)的食管鱗狀細(xì)胞癌(ESCC)中的m5C高甲基化通過增強LIN28B依賴的GRB2 mRNA穩(wěn)定性,激活致癌的PI3K/AKT和ERK/MAPK信號,促進(jìn)ESCC的起始和進(jìn)展。NSUN2通過以m5C依賴方式上調(diào)TEAD1增強下咽鱗狀細(xì)胞癌(HPSCC)的增殖和侵襲。在HCC中,NSUN2介導(dǎo)的m5C修飾在HCC中明顯高于相鄰非癌組織。m5C通過抑制Ras通路活性并增加HCC細(xì)胞對索拉非尼的敏感性來調(diào)控HCC進(jìn)展,并且m5C修飾的lncRNA H19招募G3BP1致癌蛋白促進(jìn)HCC發(fā)生和發(fā)展。此外,蛋白質(zhì)翻譯后修飾通過修飾RNA甲基化reader蛋白參與調(diào)控m5C靶標(biāo),并影響腫瘤發(fā)生。SIAH1通過泛素化和降解YBX1間接促進(jìn)m5C修飾RNA不穩(wěn)定性,抑制上皮卵巢癌細(xì)胞的增殖、侵襲、遷移和藥物抗性。
幾項研究表明m7G tRNA修飾影響癌癥進(jìn)展。METTL1/WDR4敲除破壞m7G tRNA解碼密碼子形成,降低mRNA翻譯效率并抑制肺癌、HCC、BC和鼻咽癌(NPC)進(jìn)展。METTL1介導(dǎo)的HeLa細(xì)胞中mRNA內(nèi)部m7G也增強其靶標(biāo)mRNA的翻譯效率,而不依賴其對全局翻譯和tRNA甲基化的影響。METTL1催化的人類臍靜脈內(nèi)皮細(xì)胞中VEGFA mRNA上的m7G組裝增加了VEGFA翻譯,并促進(jìn)缺血后血管生成。這些研究表明內(nèi)部m7G可能參與癌癥進(jìn)展。
總體而言,RNA甲基化修飾在腫瘤發(fā)生過程中發(fā)揮著關(guān)鍵作用,但不同修飾是否在腫瘤發(fā)生中協(xié)同或拮抗作用值得進(jìn)一步研究。此外,盡管許多由RNA甲基化修飾調(diào)控的靶標(biāo)和通路具有腫瘤診斷和治療的潛力,但實際應(yīng)用于臨床設(shè)置很少,需要進(jìn)一步深入研究以促進(jìn)臨床應(yīng)用。
結(jié)論與展望
本文總結(jié)了包括m6A、m5C和m7G在內(nèi)的三種甲基化表觀轉(zhuǎn)錄組的調(diào)控元件、分布特征、檢測技術(shù)以及生物學(xué)功能。由于RNA甲基化修飾在調(diào)控多種生理功能中的參與,主要概述了幾個熱點話題,包括配子發(fā)生、早期胚胎發(fā)生、免疫系統(tǒng)發(fā)育和疾病。盡管m6A和m5C RNA修飾的調(diào)控元件已經(jīng)被發(fā)現(xiàn)并廣泛研究,但關(guān)于其他RNA甲基化修飾的信息相對較少,特別是其erasers和readers需要確定。隨著對其他RNA甲基化修飾動態(tài)性質(zhì)的調(diào)控元件和機制的深入研究,對其功能機制的更清晰理解將有助于建立整體RNA表觀遺傳修飾調(diào)控網(wǎng)絡(luò)。
盡管已經(jīng)開發(fā)了各種RNA甲基化修飾的測序技術(shù),但它們中的大多數(shù)只能很好地捕獲和分析高豐度而不是低豐度轉(zhuǎn)錄本中的修飾信息,而后者將是一個有意義的突破點。此外,越來越多的研究表明RNA甲基化修飾參與多種生物過程和腫瘤發(fā)生。然而,幾乎所有的研究都是在群體細(xì)胞水平上進(jìn)行的,這可能會忽視或扭曲單個細(xì)胞中的真實信息,限制對精確調(diào)控機制的理解,這對于指導(dǎo)疾病的精確靶向治療可能至關(guān)重要。因此,開發(fā)高通量單細(xì)胞RNA甲基化技術(shù)應(yīng)該是該領(lǐng)域的創(chuàng)新點和推動力。此外,幾項研究也表明多種RNA甲基化修飾可能共同調(diào)控某些生物過程。因此,探索不同RNA修飾之間的相互調(diào)控關(guān)系可能是未來的一個熱點話題,這對于構(gòu)建整體RNA表觀遺傳修飾調(diào)控網(wǎng)絡(luò)是必要的。目前能夠同時捕獲多種修飾的測序技術(shù)仍然相對較少,修飾類型的覆蓋范圍和靈敏度仍需改進(jìn)。因此,開發(fā)新技術(shù)以同時檢測多種RNA表觀遺傳修飾是理解生物系統(tǒng)中整體作用模式的必要條件。
從文章的疾病部分來看,RNA表觀遺傳修飾及其調(diào)控因子在各種腫瘤的增殖、侵襲和遷移中發(fā)揮重要作用。此外,多個RNA甲基化修飾基因或其通路已被報道作為診斷或治療的潛在靶標(biāo),但其目前的臨床應(yīng)用仍然非常有限。因此,需要加強特定RNA甲基化修飾抑制劑的研究,這可能是實現(xiàn)RNA甲基化修飾臨床轉(zhuǎn)化應(yīng)用的關(guān)鍵點,盡管已有一些抑制劑的報道,如FTO抑制劑、Meclofenamic酸、FB23/FB23-2、MA2、Entacapone、DAC51、R-2HG、CS1/CS2、METTL3抑制劑(包括Compound 2/Compound 7)、STM2457、YTHDF2抑制劑(包括DC-Y13-27)和IGF2BP1抑制劑(包括BTYNB)。此外,幾項研究表明RNA甲基化修飾可以用于靶向編輯。在細(xì)胞水平上,表達(dá)與截短的METTL3甲基轉(zhuǎn)移酶結(jié)構(gòu)域融合的核定位dCas13,與修飾的METTL3-METTL14甲基轉(zhuǎn)移酶復(fù)合體和特定導(dǎo)向RNA融合的細(xì)胞質(zhì)定位,有能力在mRNA中將特定位點的腺苷修飾為m6A。Liu等人(2019b年)還設(shè)計了一個m6A動態(tài)編輯系統(tǒng),將CRISPR-Cas9與單鏈m6A甲基轉(zhuǎn)移酶METTL3:METTL14融合以在特定位點編程m6A形成,同時將CRISPR-Cas9與ALKBH5或FTO融合以實現(xiàn)RNA的位點特異性去甲基化。然而,這些技術(shù)都是基于細(xì)胞內(nèi)編輯相關(guān)蛋白的表達(dá),使得直接治療如人類腫瘤等疾病變得困難,而其他RNA甲基化的RNA編輯技術(shù)大多未知。此外,考慮到RNA甲基化修飾對mRNA代謝和翻譯有顯著影響,研究體外RNA甲基化靶向編輯技術(shù)對于增強mRNA藥物的效力具有重要意義。
總之,對RNA甲基化修飾的調(diào)控蛋白組分、測序技術(shù)、功能機制、抑制劑和靶向編輯技術(shù)的深入研究將提供關(guān)于RNA甲基化修飾在生物發(fā)育和疾病發(fā)生中功能角色的廣闊視野,對于疾病診斷和治療也具有寶貴的視角。

mRNA的分布特征和調(diào)控元件
m6A
m6A是研究最廣泛的RNA甲基化修飾類型,幾乎存在于所有類型的RNA中,包括染色質(zhì)相關(guān)新生pre-mRNA(chromatin-associated nascent pre-mRNA,caRNA)、成熟mRNA和非編碼RNA(ncRNA)。約25%哺乳動物細(xì)胞mRNA含有m6A,每個轉(zhuǎn)錄本平均含有三個m6A殘基。利用LC-MS/MS技術(shù)鑒定出人類mRNA中m6A/A占比約0.4%–1.79%。m6A主要位于內(nèi)部mRNA中,特別是在靠近終止密碼子和mRNA的3′UTRs區(qū)域。m6A的保守motif序列是RRACH(R=A/G,H=A/C/U)。m6A的分布特征表明m6A可能廣泛參與mRNA代謝,如可變剪切、翻譯等,從而在生理和病理過程中發(fā)揮重要作用。m6A甲基化形成由甲基轉(zhuǎn)移酶(“writers”)催化,主要由METTL3、METTL14和WTAP組成,以及其他蛋白亞基,包括ZC3H13/Hakai/Virilizer、KIAA1429(VIRMA)、RBM15/15B。METTL16也是METTL同源家族蛋白之一,催化MAT2A mRNA和U6 snRNA上的m6A形成。同時m6A甲基基團能夠被去甲基化酶(“erasers”)去除,主要包括FTO和ALKBH5家族成員。m6A修飾的RNA堿基位點被特定的結(jié)合蛋白(“readers”)識別以執(zhí)行多樣的生物學(xué)功能。迄今為止已鑒定的m6A readers包括YTH結(jié)構(gòu)域蛋白(YTHDC1-2、YTHDF1-3)、核異質(zhì)核糖核蛋白(HNRNPC、HNRNPA2B1)、類胰島素生長因子2 mRNA結(jié)合蛋白(IGF2BP1-3)、真核起始因子3(eIF3)(表1)。
m5C
m5C是另一種常見且豐富的RNA修飾,存在于各種RNA中,包括mRNA、tRNA、rRNA和vtRNA。在人類和小鼠的mRNA中,m5C位于翻譯起始位點(TSS)的下游區(qū)域,通過LC-MS/MS檢測人類mRNA中m5C/C占比約為0.02%–0.09%。
與m6A類似,m5C修飾也由其“writers”和“erasers”動態(tài)調(diào)控。已經(jīng)鑒定的幾個m5C甲基轉(zhuǎn)移酶(writers),包括NOL1/NOP2/SUN結(jié)構(gòu)域家族成員(NSUN1-7)、DNA甲基轉(zhuǎn)移酶同源物(DNMT2)和特異性tRNA甲基轉(zhuǎn)移酶家族成員(TRDMT4A和TRDMT4B),其中NSUN2和NSUN6能夠催化mRNA上m5C形成。Tet家族蛋白(TET1和TET2)不僅催化DNA上5mC到5-羥甲基胞嘧啶(5hmC)的形成,還介導(dǎo)mRNA中m5C氧化。目前,有兩種主要類型的mRNA m5C readers蛋白,其具有特殊的RNA結(jié)合域,以決定m5C修飾RNA分子的不同命運,包括RNA和出口因子結(jié)合蛋白2(ALYREF)和Y-box結(jié)合蛋白(YBX1和YBX2)(表1)。
m7G
m7G也是一種普遍存在的RNA甲基化修飾,被發(fā)現(xiàn)位于真核生物的18S rRNA和tRNA變環(huán)以及microRNA(miRNA)中。此外,大多數(shù)真核mRNA在N7-鳥嘌呤的5′帽端含有m7G修飾。隨著靈敏度更高的檢測和定位技術(shù)發(fā)展,研究人員最近發(fā)現(xiàn)m7G修飾存在于mRNA內(nèi)部區(qū)域。在人類和小鼠細(xì)胞系的去帽poly(A)+ mRNA中,m7G/G占比約為0.02%–0.05%,占相同細(xì)胞中m6A/A的5%–10%(使用LC-MS/MS)。Zhang等人(2019b)報告稱,m7G峰值主要積聚區(qū)域位于3′UTR,次要區(qū)域在5′UTR內(nèi)部mRNA中。另一項報告也發(fā)現(xiàn),人類和小鼠mRNA內(nèi)部的m7G修飾富集在5′UTR,特別是在翻譯起始位點附近的AG富集區(qū)域。
與m6A和m5C相比,關(guān)于m7G調(diào)控因子的研究才剛剛開始。報道的m7G甲基轉(zhuǎn)移酶包括Trm8p/Trm82p復(fù)合體和酵母中的Bud23/Trm112,以及哺乳動物中相應(yīng)的同源物METTL1/WDR4和WBSCR22/TRMT112,其中METTL1不僅介導(dǎo)tRNA上的m7G修飾,還催化mRNA內(nèi)部m7G修飾。此外,RNMT和RAM復(fù)合體參與催化哺乳動物N7-鳥嘌呤5′帽端的m7G修飾的形成。最新研究報告稱,QKI(QKI15、QKI16和QKI17)是mRNA內(nèi)部m7G修飾的第一個reader蛋白,它在應(yīng)激條件下與G3BP1互作,抑制m7G修飾的mRNA形成應(yīng)激顆粒,同時調(diào)控Hippo信號通路中關(guān)鍵基因的穩(wěn)定性和翻譯效率(表1)。
檢測技術(shù)
基于Bulk RNA甲基化檢測技術(shù)
基于免疫沉淀方法
抗體和免疫沉淀的RNA甲基化檢測策略,是一種簡單、穩(wěn)定且低成本的方法,傳統(tǒng)上被廣泛用于各種生物的表觀轉(zhuǎn)錄組特征圖譜繪制。典型的技術(shù)分為兩類:基于RNA甲基化抗體的(包括m6A/m5C/m7G-MeRIP-seq、m6A/m7G-miCLIP-seq、PA-m6A-seq和m6A-LAIC-seq)和基于甲基轉(zhuǎn)移酶抗體的(m5C-miCLIP-Seq和AZA-IPseq)。
(1) MeRIP-seq
大多數(shù)用于RNA甲基化修飾的高通量測序技術(shù)依賴于特定甲基化抗體(如m6A、m5C和m7G)。甲基化RNA免疫沉淀測序(MeRIP-seq),如m6A-MeRIP-Seq(m6A-seq)(圖1A)、m5C-MeRIP-Seq(圖2A)和m7G-MeRIP-Seq(圖3A)是常用的方法,用于鑒定mRNA中的RNA甲基化peaks。然而,MeRIP-seq存在一些缺點,如相對較低的檢測分辨率(約100-150 nt)和對低豐度RNA上的RNA甲基化位點不敏感。Molinie等人(2016年)改進(jìn)的m6A-MeRIP-seq開發(fā)了m6A-LAIC-seq(m6A水平和異構(gòu)體特征序列),通過調(diào)整抗體使用、涉及各種內(nèi)標(biāo)調(diào)控和同時進(jìn)行上清液(m6A陰性部分)的NGS測序,計算m6A陽性和m6A陰性部分的RNA表達(dá),以在全轉(zhuǎn)錄組范圍內(nèi)定量m6A的化學(xué)計量學(xué)(表2)。
(2) miCLIP-seq
通過將MeRIP技術(shù)與光交聯(lián)反應(yīng)結(jié)合,研究人員發(fā)明了UV誘導(dǎo)的抗體-RNA交聯(lián)方法來檢測轉(zhuǎn)錄組甲基化修飾,如PA-m6A-Seq(光交聯(lián)輔助m6A測序)(圖1C)、m6A-CLIP(m6A交聯(lián)免疫沉淀)(和m6A/m7G-miCLIP(m6A/m7G甲基化單堿基分辨率交聯(lián)免疫沉淀)(圖1B和3B)。m6A-CLIP和m6A/m7G-miCLIP均基于UV交聯(lián)RNA與m6A或m7G抗體在結(jié)合位點形成共價鍵,導(dǎo)致逆轉(zhuǎn)錄過程中的C-T位點轉(zhuǎn)換或截斷,通過此方法可以準(zhǔn)確鑒定m6A位點并獲得單堿基分辨率甲基化圖譜(表2)。
(3) PA-m6A-seq
PA-m6A-seq(光交聯(lián)輔助m6A測序)方法依賴于4-硫尿苷(4SU,光敏感的核苷酸類似物)在細(xì)胞培養(yǎng)期間并入poly(A) RNA中,抗m6A免疫沉淀和UV交聯(lián),隨后進(jìn)行靶向RNA洗脫和文庫構(gòu)建(圖1C)。與MeRIP-Seq或m6A-seq相比,該方法實現(xiàn)哺乳動物接近單堿基分辨率全轉(zhuǎn)錄組m6A圖譜(表2)。
(4) m5C-miCLIP-seq
甲基轉(zhuǎn)移酶可以催化體內(nèi)特定核酸堿基位點的RNA甲基化形成。m5C甲基轉(zhuǎn)移酶NSUN2包含釋放(半胱氨酸271)和催化(半胱氨酸321)位點。m5C-miCLIP(m5C甲基化單堿基分辨率交聯(lián)和免疫沉淀)利用這一特性,通過結(jié)合細(xì)胞中外源表達(dá)的NSUN2-C271A(NSUN2上的突變釋放位點)與UV交聯(lián)免疫沉淀,其中突變蛋白NSUN2-C271A和m5C修飾位點在UV交聯(lián)下強烈結(jié)合形成共價鍵,這在RT-PCR過程中引起截斷或突變(圖2B)。因此,m5C-miCLIP也能夠以單堿基分辨率檢測m5C修飾位點(表2)。
(5) AZA-IP-seq
AZA-IP-seq(5-氮胞嘧啶介導(dǎo)的RNA免疫沉淀測序)是另一種基于甲基轉(zhuǎn)移酶抗體的m5C檢測方法。簡要來說,5-氮胞嘧啶(5-azaC),作為DNA甲基轉(zhuǎn)移酶抑制劑之一,可以隨機并入DNA和新生RNA中,并且也有能力與甲基轉(zhuǎn)移酶(外源和內(nèi)源)結(jié)合形成共價鍵。結(jié)合5-azaC處理和特定甲基轉(zhuǎn)移酶抗體(如NSUN2)的免疫沉淀,可以以單堿基分辨率檢測m5C修飾位點(圖2A,表2)。

表1:mRNA甲基化修飾調(diào)控因子綜述
基于化學(xué)反應(yīng)方法
(1) RNA-BisSeq
RNA亞硫酸鹽測序(RNA-BisSeq)是定量分析mRNA m5C甲基組的經(jīng)典方法之一。它依賴于用亞硫酸鹽預(yù)處理RNA,促使未修飾的C發(fā)生化學(xué)脫氨反應(yīng)并轉(zhuǎn)化為U,而甲基化的胞嘧啶(m5C)保持為C。經(jīng)過RT、cDNA合成和PCR過程后,U堿基轉(zhuǎn)化為T,從而可以區(qū)分m5C和C。通過生物信息學(xué)分析,可以通過分析未轉(zhuǎn)化的胞嘧啶來鑒定m5C修飾位點,同時,通過計算未轉(zhuǎn)化胞嘧啶的覆蓋率百分比來估計m5C甲基化水平(圖2D)。總的來說,RNA-BisSeq不需要在細(xì)胞中表達(dá)外源基因或化學(xué)試劑,能夠準(zhǔn)確捕獲細(xì)胞和組織中原始的m5C修飾狀態(tài)。RNA-BisSeq被廣泛用于探索各種RNA中m5C的表達(dá)特征,并預(yù)測其潛在功能,包括哺乳動物、斑馬魚、擬南芥和水稻。RNA-BisSeq中m5C檢測的準(zhǔn)確性取決于亞硫酸鹽處理過程中C到U的轉(zhuǎn)化效率,這受到反應(yīng)條件(如溫度、反應(yīng)時間)和RNA狀態(tài)(如RNA質(zhì)量、RNA二級結(jié)構(gòu)等)的影響(表2)。
(2)m6A-SEAL-seq
FTO輔助的m6A選擇性化學(xué)標(biāo)記測序(m6A-SEAL-seq)是一種利用FTO作為催化劑將m6A轉(zhuǎn)化為hm6A(N6-羥甲基腺苷)的化學(xué)標(biāo)記方法。不穩(wěn)定的hm6A將通過二硫蘇糖醇(DTT)介導(dǎo)的硫醇加成化學(xué)反應(yīng)轉(zhuǎn)化為更穩(wěn)定的dm6A(N6-二硫代肌醇甲腺苷)。然后,dm6A通過甲硫磺酸鹽(MTSEA)響應(yīng)組裝生物素標(biāo)簽,隨后進(jìn)行鏈霉親和純化和測序(圖1D)。m6A-SEAL分辨率約為200 nt(表2)。
(3) m6A-label-seq
這種技術(shù)基于甲硫氨酸類似物Se-烯丙基硒代同型半胱氨酸作為人類和小鼠細(xì)胞的培養(yǎng)營養(yǎng)物質(zhì)。這種類似物可以驅(qū)動甲基供體SAM被烯丙基團標(biāo)記,通過細(xì)胞自身代謝形成Allyl-SAM或Allyl-SeAM。因此,細(xì)胞RNA能夠在假定m6A生成腺苷位點被代謝性地修飾為N6-烯丙基腺苷(a6A)。基于碘化誘導(dǎo)的a6A環(huán)化和在cDNA逆轉(zhuǎn)錄過程中對側(cè)位點錯配,實現(xiàn)全轉(zhuǎn)錄組范圍內(nèi)單堿基分辨率檢測。m6A-label-seq的建立為理解m6A在分子水平上的生理作用提供了強有力的工具,并且可以應(yīng)用于所有m6A motif。烯丙基團標(biāo)記的效率和時間窗口對于準(zhǔn)確鑒定m6A位點至關(guān)重要(表2)。
(4) m6A-SAC-seq
m6A選擇性烯丙基化學(xué)標(biāo)記和測序(m6A-SAC-seq)是單堿基分辨率繪制全轉(zhuǎn)錄組m6A圖譜方法之一。這種方法的本質(zhì)是使用Dim1/KsgA家族的二甲基轉(zhuǎn)移酶酶(MjDim1)在m6A上添加烯丙基SAM化學(xué)基團形成烯丙基6m6A,隨后在I2處理后發(fā)生環(huán)化。環(huán)化的烯丙基6m6A在逆轉(zhuǎn)錄過程中將被read為突變。根據(jù)突變reads,可以定量和分析轉(zhuǎn)錄組中m6A沉積位點(圖1F)。m6A-SAC-seq能夠覆蓋幾乎所有經(jīng)典的m6A motif,并已應(yīng)用于檢測HeLa、HEK293、HepG2以及造血干細(xì)胞(HSC)和單核細(xì)胞中的m6A水平。m6A-SAC-seq的初始樣本量約為30ng的poly(A)或rRNA耗盡RNA(表2)。
(5) GLORI
類似于RNA m5C的RNA-BisSeq,乙二醛和亞硝酸鹽介導(dǎo)的未甲基化腺苷的脫氨(GLORI)也是一種無偏倚、絕對基于化學(xué)反應(yīng)的m6A定量方法。該程序包含三個連續(xù)步驟:①使用乙二醛形成可逆結(jié)構(gòu)保護G(N1, N2-二羥基鳥嘌呤加合物)以避免亞硝酸鹽誘導(dǎo)的G脫氨;②未甲基化的A通過亞硝酸鹽催化的脫氨反應(yīng)轉(zhuǎn)化為I;③通過堿性或加熱條件處理實現(xiàn)G的脫保護(圖1G)。GLORI的主要優(yōu)勢是實現(xiàn)RNA中m6A定量分析,但GLORI成本高于m6A MeRIP-seq,且GLORI無法區(qū)分m6A和其他一些A修飾,如m6Am和m1A,盡管技術(shù)發(fā)明者聲稱已開發(fā)出分析流程來消除由m6Am和m1A引起的假陽性(表2)。
(6) eTAM-seq
進(jìn)化的TadA輔助N6-甲基腺苷測序(eTAM-seq)是一種基于酶促脫氨反應(yīng)的單堿基分辨率m6A測序方法,用于全轉(zhuǎn)錄組范圍內(nèi)定量檢測m6A位點。簡要來說,使用高活性的tRNA腺苷脫氨酶TadA8.20進(jìn)行脫氨反應(yīng),全局未甲基化的A轉(zhuǎn)化為I,只能與C配對并在隨后的逆轉(zhuǎn)錄、文庫構(gòu)建和測序過程中被讀為G。修飾的m6A保持不變,在測序過程中仍然被讀為A。因此,通過eTAM-seq,A被讀為G,m6A被讀為A。eTAM-seq能夠在極少量RNA中(低至10個細(xì)胞的RNA)進(jìn)行m6A的定量檢測,其初始RNA需求遠(yuǎn)低于現(xiàn)有的m6A定量分析方法(圖1H)。
(7) TAWO-seq
TET輔助的過鎢酸鹽氧化測序(TAWO-seq)也是一種 RNA m5C單堿基分辨率測序方法,主要包含三個連續(xù)程序,包括由β-葡萄糖轉(zhuǎn)移酶(βGT)標(biāo)記保護的原始hm5C,由TET酶氧化的原始m5C轉(zhuǎn)化為hm5C,以及由過鎢酸鹽介導(dǎo)的新生成hm5C的選擇性氧化為三羥基胸腺嘧啶(thT)(圖2E)。這項技術(shù)的最大優(yōu)勢是與RNA-BisSeq相比能夠區(qū)分m5C和hm5C。
(8) m7G-seq
m7G上的正電荷對NaBH4介導(dǎo)的還原特別敏感。m7G-seq采用NaBH4介導(dǎo)的還原,在m7G位置上產(chǎn)生一個堿性位點,然后這些位點被生物素標(biāo)記,隨后進(jìn)行生物素下拉實驗。在逆轉(zhuǎn)錄過程中,RNA中的生物素標(biāo)記m7G位點會導(dǎo)致錯配(主要是T以及其他堿基),從而實現(xiàn)基于這些突變的m7G甲基組的單堿基分辨率(圖3C,表2)。
基于酶切反應(yīng)技術(shù)
MAZTER-seq和m6A-REF-seq(m6A敏感的RNA內(nèi)切核酸酶促進(jìn)的測序)是同時報道不依賴抗體的方法,用于定量m6A的化學(xué)計量分析。這兩種方法都依賴于RNA內(nèi)切核酸酶MazF對ACA motif上的m6A識別,能夠在全轉(zhuǎn)錄組范圍內(nèi)以單堿基分辨率檢測m6A修飾位點及其豐度。MazF在mRNA上更傾向于識別A-CA motif。由于RNA上m6A的motif是RRACH(R=A/G,H=A/C/U),大多數(shù)經(jīng)過MazF酶處理后的讀段將在5'端含有ACA,因此內(nèi)部的(m6A)CA基序被認(rèn)定為甲基化位點(圖1I和J)。然而,這兩種方法都受限于內(nèi)切核酸酶對m6A CA序列的選擇性,這使得不包含m6A CA序列的序列無法被識別(表2)。
基于RNA編輯的技術(shù)
DART-seq(脫氨基作用鄰近RNA修飾靶標(biāo)測序)是一種不依賴抗體的方法,通過在哺乳動物細(xì)胞中表達(dá)外源性的APOBEC1-YTH融合蛋白來檢測全局m6A修飾位點。其中,YTH(m6A結(jié)合域)識別m6A,而連接的APOBEC1(胞嘧啶脫氨酶)直接將胞嘧啶殘基上的C編輯為U。這些編輯位點在后續(xù)的數(shù)據(jù)分析中被識別為m6A修飾區(qū)域(圖1K)。由于YTH結(jié)構(gòu)域與m6A的2'-OH之間的氫鍵鍵合是關(guān)鍵結(jié)構(gòu),DART-seq中的YTH結(jié)構(gòu)域無法識別m6Am。盡管DART-seq能夠從低量RNA(約10 ng總RNA)中繪制m6A位點,但需要將APOBEC1-YTH短暫轉(zhuǎn)染入哺乳動物細(xì)胞要求限制了其應(yīng)用,并且可能破壞了生理狀態(tài)(表2)。

圖1:mRNA甲基化測序技術(shù)的發(fā)展。過去十年m6A測序技術(shù)取得快速發(fā)展,在單堿基分辨率(約八種類型)和單細(xì)胞水平(約三種類型)上取得了突破:包括基于m6A抗體的(A)m6A-seq/MeRIP-seq、(B)miCLIP和(C)PA-m6A-seq;基于化學(xué)反應(yīng)的(D)m6A-SEAL-seq、(E)m6A-label-seq、(F)m6A-SPAC-seq和(G)GLORI、(H)eTAM-seq。

圖2:mRNA m5C甲基化測序技術(shù)。基于抗體m5C檢測方法,包括基于甲基轉(zhuǎn)移酶或其融合標(biāo)簽抗體的技術(shù)(A)AZA-seq和(B)m5C miCLIP-seq,以及基于m5C抗體的方法(C)m5C MeRIP-seq。基于化學(xué)反應(yīng)的技術(shù)是(D)RNA-BisSeq和(E)TAWO-seq。


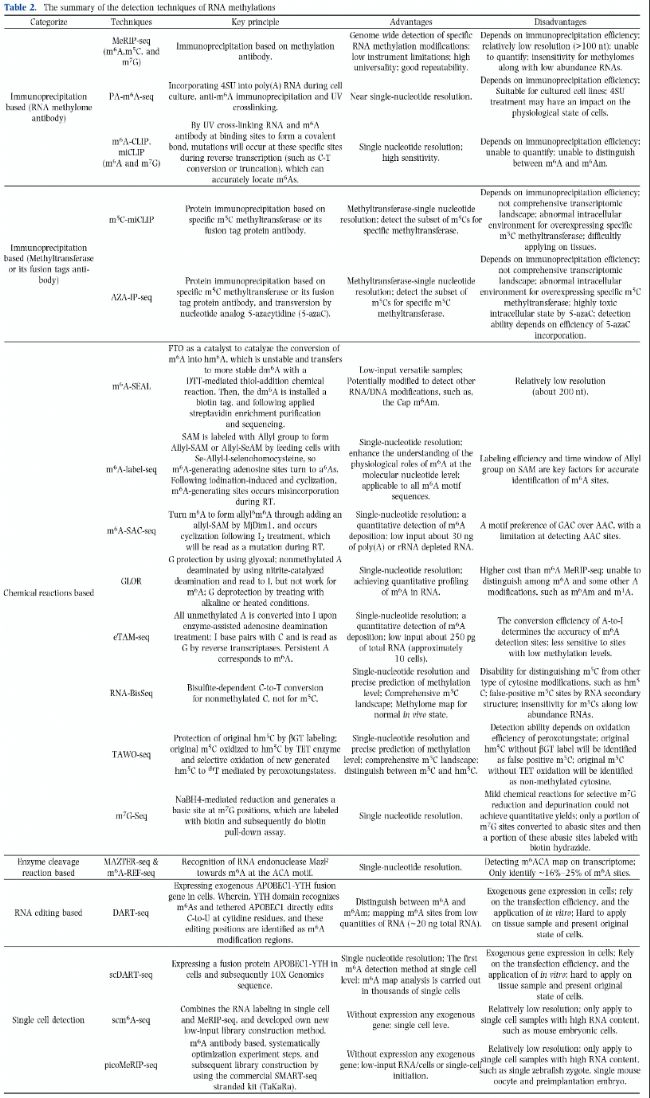
表2:RNA甲基化檢測技術(shù)綜述
基于單細(xì)胞RNA甲基化檢測技術(shù)與單細(xì)胞組學(xué)圖譜相比,傳統(tǒng)的群體細(xì)胞測序方法使用的樣本包含成千上萬個細(xì)胞,因此只能反映群體中的平均甲基化水平。特別是,細(xì)胞表達(dá)的異質(zhì)性在很大程度上被掩蓋,無法準(zhǔn)確反映組織/器官的真實生理或病理特征。目前已經(jīng)建立單細(xì)胞水平的測序技術(shù),用于繪制轉(zhuǎn)錄組、染色質(zhì)開放可及性、DNA甲基化修飾等圖譜。報道的單細(xì)胞轉(zhuǎn)錄組甲基化圖譜技術(shù)包括scDART-seq和scm6A-seq。
(1) scDART-seq
scDART-seq是在引入10X Genomics單細(xì)胞測序后從DART-seq發(fā)展而來,是首個單細(xì)胞水平的m6A檢測方法。通過應(yīng)用scDART-seq,在成千上萬個單細(xì)胞中進(jìn)行m6A圖譜分析,發(fā)現(xiàn)m6A在單細(xì)胞水平上表現(xiàn)出高度異質(zhì)性,并且可以根據(jù)RNA甲基化特征區(qū)分細(xì)胞亞群,與基因表達(dá)水平無關(guān)。這些發(fā)現(xiàn)揭示以前在bulk-cell m6A分析中被忽視的m6A基本特征,并為理解m6A在不同細(xì)胞中的功能提供新見解(圖1L)。但由于scDART-seq基于外源基因表達(dá),因此很難應(yīng)用于組織樣本,也無法呈現(xiàn)細(xì)胞的原始狀態(tài)(表2)。
(2) scm6A-seq
通過結(jié)合RNA多重標(biāo)記和MeRIP-seq/m6A-IP,scm6A-seq能夠捕獲全轉(zhuǎn)錄組范圍的m6A圖譜,并能夠在不表達(dá)任何外源基因的情況下比較單細(xì)胞中的m6A水平。它已被用于區(qū)分有核仁包圍(SN)和無核仁包圍(NSN)的卵母細(xì)胞,以單細(xì)胞分辨率繪制小鼠卵母細(xì)胞發(fā)育和合子基因組激活期間的m6A調(diào)控機制(圖1M,表2)。
(3) picoMeRIP-seq
picoMeRIP-seq也是一種基于m6A抗體的低輸入RNA/細(xì)胞或單細(xì)胞啟動的m6A圖譜方法。與scm6A-seq相比,picoMeRIP-seq不標(biāo)記單細(xì)胞中的RNA,后續(xù)文庫構(gòu)建直接使用商業(yè)的SMART-Seq stranded kit(TaKaRa)。在這種方法中,通過系統(tǒng)優(yōu)化關(guān)鍵步驟提高了m6A/A富集比率,包括增加洗滌劑(SDS)和鹽(NaCl)濃度,使用低結(jié)合管和商業(yè)m6A抗體(Millipore)等(圖1N)。picoMeRIP-seq已用于在100 pg poly(A) RNA、單個斑馬魚合子、單個小鼠卵母細(xì)胞和植入前胚胎、小鼠胚胎干細(xì)胞(1,000、100和10個細(xì)胞)的全轉(zhuǎn)錄組水平上繪制m6A(表2)。
綜上所述,過去十年中RNA甲基化測序技術(shù)的快速發(fā)展使我們能夠更清晰地了解RNA甲基化修飾的分布特征和功能機制。盡管每種技術(shù)都有其自身的優(yōu)勢和劣勢,但它們可以從多個維度進(jìn)行補償或校正,以獲得更準(zhǔn)確的RNA甲基化位點信息。此外,在單堿基精度和單細(xì)胞水平上取得了技術(shù)突破,這可以更精細(xì)地捕獲細(xì)胞間RNA甲基化的異質(zhì)性,并建立單細(xì)胞水平的RNA甲基化調(diào)控網(wǎng)絡(luò)。
生物學(xué)功能
RNA過程和代謝
作為轉(zhuǎn)錄后修飾,RNA甲基化參與RNA代謝的整個過程,如pre-mRNA剪切、mRNA出核、mRNA降解或穩(wěn)定性以及mRNA翻譯。
pre-mRNA剪切
pre-mRNA剪切作為基因表達(dá)轉(zhuǎn)錄后調(diào)控的第一階段,是去除pre-mRNA中內(nèi)含子、有序連接外顯子以最終生成成熟mRNA的過程。pre-mRNA可變剪切是這一過程中的關(guān)鍵步驟,它可以從一個基因生成多個轉(zhuǎn)錄本,為遺傳多樣性和復(fù)雜性做出貢獻(xiàn)。m6A去甲基化酶(FTO和ALKBH5)和甲基轉(zhuǎn)移酶復(fù)合體(WTAP、METTL3和METTL14)定位于核斑點中,提示m6A在RNA剪切中的潛在作用。FTO優(yōu)先結(jié)合內(nèi)含子區(qū)域pre-mRNA,靠近可變剪切(AS)外顯子和聚腺苷酸位點,并調(diào)控可變剪切和3′UTR表達(dá)。
m6A reader蛋白hnRNPG結(jié)合到共轉(zhuǎn)錄新生的m6A修飾pre-mRNA,并通過對RNA聚合酶II的互作及其在hnRNPG調(diào)控外顯子周圍的占位影響來調(diào)控可變剪切。此外,m6A分布在圍繞5′-和3′-剪切位點的外顯子區(qū)域,并與SRSF1和SRSF2的結(jié)合簇空間重疊。在3T3-L1細(xì)胞中敲除FTO增強了m6A水平,并促進(jìn)了SRSF2蛋白的RNA結(jié)合能力,該蛋白調(diào)控脂肪生成調(diào)控因子RUNX1T1的可變剪切和隨后的前脂肪細(xì)胞分化。同時,有報道稱m6A參與依賴其閱讀蛋白YTHDC1的pre-mRNA剪切,促進(jìn)pre-mRNA剪切因子SRSF3(SRp20)而阻止SRSF10(SRp38)進(jìn)入目標(biāo)mRNA的結(jié)合區(qū)域。小鼠卵母細(xì)胞中的Ythdc1與pre-mRNA 3′端處理因子(CPSF6、SRSF3和SRSF7)互作,并以m6A依賴方式廣泛參與可變聚腺苷酸化和改變3′UTR長度。果蠅中YTH家族蛋白的同源物YT521-B介導(dǎo)依賴于m6A的pre-mRNA可變剪切,并調(diào)控果蠅的神經(jīng)功能和性別決定。Louloupi等人報告稱,剪切位點上的m6A沉積促進(jìn)快速剪切,而內(nèi)含子中高m6A水平與慢可變剪切相關(guān)。有趣的是,m6A開關(guān)調(diào)控HNRNPC結(jié)合活性,其中m6A主導(dǎo)RNA和reader蛋白互作的RNA結(jié)構(gòu)依賴性可及性,促進(jìn)外顯子保守并影響目標(biāo)mRNA的可變剪切。總的來說,m6A對pre-mRNA成熟過程發(fā)揮重要作用,但m5C或m7G是否也參與這一過程尚不清楚。
mRNA出核
mRNA出核是基因表達(dá)過程中的關(guān)鍵步驟,mRNA通過這一步驟被轉(zhuǎn)運到細(xì)胞質(zhì)中進(jìn)行翻譯。大多數(shù)mRNA出核依賴于轉(zhuǎn)錄出核復(fù)合體(TREX)和核異二聚體出核受體(NXF1-P15)通路,其中TREX復(fù)合體成員被沉積在mRNA上并將其交給NXF1。
YTHDC1通過剪切因子SRSF3和出核接頭NXF1促進(jìn)含m6A的mRNA出核。研究發(fā)現(xiàn)多個TREX亞基(ALYREF、UAP56、THOC5、CHTOP)與m6A甲基轉(zhuǎn)移酶復(fù)合體(WTAP、METTL3、METTL14、KIAA1429)互作,調(diào)控轉(zhuǎn)錄本出核。Mettl3在細(xì)胞核中顯著增加了時鐘基因Per2和Arntl的mRNA積累,而細(xì)胞中ALKBH5缺失加速了mRNA的RNA出核。同時,HeLa細(xì)胞中YTHDC1缺失導(dǎo)致m6A修飾的mRNA核積聚,而在細(xì)胞質(zhì)中缺失。
除了m6A,m5C也在mRNA出核中發(fā)揮關(guān)鍵作用。ALYREF不僅是m5C reader蛋白,也是調(diào)控核質(zhì)穿梭的TREX亞基之一。在HeLa細(xì)胞中,ALYREF促進(jìn)含m5C的mRNA出核。3T3-L1細(xì)胞中NSUN2的缺乏導(dǎo)致ALYREF-m5C軸介導(dǎo)的CDKN1A mRNA出核減少,導(dǎo)致細(xì)胞周期加速和促進(jìn)脂肪形成。
mRNA降解和穩(wěn)定性
m6A修飾參與調(diào)控mRNA代謝。在野生型mESCs中,Mettl3和Mettl14組成的甲基轉(zhuǎn)移酶復(fù)合體在標(biāo)靶轉(zhuǎn)錄本上催化m6A形成,隨后阻止與mRNA穩(wěn)定性相關(guān)蛋白HuR的結(jié)合,并增強microRNA靶點,導(dǎo)致目標(biāo)轉(zhuǎn)錄本不穩(wěn)定。YTHDF2是一個經(jīng)典的m6A reader蛋白,它通過多種通路促進(jìn)含有m6A的靶轉(zhuǎn)錄本降解。首先,Wang等人(2014a)分析了YTHDF2蛋白結(jié)構(gòu),發(fā)現(xiàn)YTHDF2的羧基末端域(C-YTHDF2)選擇性地識別含m6A mRNA,而氨基末端域(N-YTHDF2)負(fù)責(zé)將YTHDF2-m6A-mRNA復(fù)合體定位到更專門的mRNA降解機器(如P體等)。其次,哺乳動物細(xì)胞中的YTHDF2招募CCR4-NOT脫腺苷酸酶復(fù)合體,加速含m6A RNA的脫腺苷酸化和降解。此外,YTHDF2還與HRSP12互作,招募RNase P/MRP復(fù)合體(內(nèi)切核糖核蛋白酶復(fù)合體),以切割含m6A的RNA。YTHDF2介導(dǎo)的m6A甲基化mRNA的降解在各種發(fā)育和疾病過程中發(fā)揮關(guān)鍵作用,如維持造血干細(xì)胞功能、在卵母細(xì)胞成熟和胚胎發(fā)生過程中母源mRNA降解、癌癥進(jìn)展等。
與YTHDF2作用不同,另一個m6A reader蛋白IGF2BPs參與維持穩(wěn)定性和儲存,并在正常和應(yīng)激條件下影響目標(biāo)m6A甲基化mRNA基因表達(dá)。IGF2BPs介導(dǎo)的m6A修飾mRNA的穩(wěn)定性參與腫瘤形成。
m5C修飾在mRNA穩(wěn)定性中也表現(xiàn)出類似的作用。兩項平行研究報告稱,m5C reader蛋白YBX1通過招募RNA穩(wěn)定性相關(guān)蛋白(HuR或PABPC1a)影響目標(biāo)mRNA穩(wěn)定性,并因此參與膀胱尿路上皮癌(UCB)的腫瘤形成和轉(zhuǎn)移,以及斑馬魚胚胎發(fā)育。在小鼠Th17細(xì)胞中NSUN2缺失以m5C依賴方式導(dǎo)致Il17a和Il17f mRNAs的半衰期和數(shù)量減少。
翻譯
RNA甲基化已被證明可以促進(jìn)或抑制翻譯過程。在細(xì)胞質(zhì)中,YTHDF1富集在40S核糖體的蛋白質(zhì)亞基中,并與翻譯啟動復(fù)合體的組成部分eIF3互作,從而促進(jìn)m6A依賴的mRNA翻譯。
YTHDF3也與YTHDF1協(xié)同促進(jìn)蛋白質(zhì)合成。另一項平行研究也報告稱,YTHDF3與YTHDF1合作,通過在翻譯過程中順序招募翻譯效應(yīng)物(40S和60S核糖體亞基)來促進(jìn)m6A修飾目標(biāo)mRNA的翻譯效率。總體而言,YTHDF1和YTHDF3通過與YTHDF1/YTHDF3鏈接,在轉(zhuǎn)錄本m6A修飾的3'端和40S和60S亞基的翻譯效應(yīng)物的5'端之間形成loop,調(diào)控翻譯啟動。最近的報告還說明了幾條分子通路參與YTHDF1或YTHDF3介導(dǎo)的m6A修飾轉(zhuǎn)錄本的翻譯過程。Zou等人(2023年)報告稱,YTHDF1與核糖體蛋白結(jié)合以促進(jìn)其目標(biāo)mRNA翻譯,但FMRP通過阻礙YTHDF1與核糖體蛋白的結(jié)合來抑制神經(jīng)翻譯。然而在神經(jīng)刺激下,F(xiàn)MRP被磷酸化并釋放YTHDF1,以提高m6A甲基化mRNA翻譯效率,從而促進(jìn)神經(jīng)去極化。同時,Chen等人(2023年)已經(jīng)證明YTHDF1和YTHDF3(不是YTHDF2)攜帶高水平的營養(yǎng)感應(yīng)O-GlcNAc修飾,O-GlcNAcylation通過抑制它們與mRNA翻譯相關(guān)蛋白互作,抑制YTHDF1和YTHDF3的翻譯促進(jìn)功能,導(dǎo)致m6A甲基化mRNA翻譯抑制。Chen等人(2023年)還建議不同的細(xì)胞在YTHDF1/3上表現(xiàn)出不同的O-GlcNAc修飾水平,這可能是先前研究對YTHDF1/3是否促進(jìn)m6A RNA翻譯功能得出不同結(jié)論的原因之一。此外,當(dāng)m6A位于5'UTR時,它可以通過被43S復(fù)合體組分eIF3識別,在細(xì)胞應(yīng)激下促進(jìn)帽的單獨翻譯。另一個reader蛋白YTHDC2也以m6A依賴方式增強其靶標(biāo)翻譯效率。盡管如此,Choi等人(2016年)證明,轉(zhuǎn)錄本中m6A修飾密碼子通過破壞轉(zhuǎn)錄本上tRNA的選擇導(dǎo)致翻譯延伸動態(tài)更慢和翻譯效率更低。此外,Lin等人(2016年)發(fā)現(xiàn)METTL3,而不依賴其m6A催化活性,通過招募eIF3到翻譯啟動復(fù)合體,增強包括重要的癌基因如EGFR和TAZ在內(nèi)的目標(biāo)mRNA翻譯,導(dǎo)致人類肺癌細(xì)胞的生長、存活和侵襲得到促進(jìn)。
m5C廣泛分布在rRNA和tRNA變區(qū)和反密碼loop上,通過調(diào)控tRNA穩(wěn)定性和密碼子識別、翻譯保真度和準(zhǔn)確性或全局蛋白質(zhì)合成等參與翻譯調(diào)控。mRNA上的m5C也參與調(diào)控翻譯效率,在3T3-L1細(xì)胞中,NSUN2以m5C依賴的方式促進(jìn)CDKN1A mRNA的翻譯效率。在大鼠的T淋巴細(xì)胞中,NSun2介導(dǎo)的m5C修飾在高同型半胱氨酸血癥誘導(dǎo)下促進(jìn)IL-17A mRNA的翻譯。此外,NSUN6特異性m5C位點富集在3'UTR中的CTCCA motif上,與翻譯終止保真相關(guān)。然而,Tang等人(2015年)報告稱NSun2通過在p27 mRNA的5'UTR上的胞嘧啶C64上甲基化,抑制p27翻譯,表明mRNA上m5C位點可能決定其對翻譯效率的調(diào)控效應(yīng)。
真核mRNA的5'帽上m7G已被證明參與翻譯調(diào)控。最近的研究還表明,mRNA內(nèi)部的m7G修飾在mRNA翻譯通路中起作用。METTL1組裝的內(nèi)部m7G修飾能夠促進(jìn)m7G修飾轉(zhuǎn)錄本翻譯效率,而不依賴于其對全局翻譯和tRNA甲基化的影響。內(nèi)部m7G在人類mRNA沿的表現(xiàn)顯示在翻譯起始位點保守富集,而在H2O2或熱休克處理下在CDS和3'UTR區(qū)域顯著積累,促進(jìn)mRNA翻譯效率。此外,METTL1介導(dǎo)的m7G甲基化增強VEGFA mRNA翻譯,促進(jìn)人臍靜脈內(nèi)皮細(xì)胞(HUVECs)的血管生成。
綜上所述,RNA甲基化修飾在包括pre-RNA處理、mRNA代謝和翻譯在內(nèi)的整個mRNA表達(dá)過程中發(fā)揮重要作用,凸顯其生物學(xué)意義。Li等人(2017c)證明METTL3/METTL14介導(dǎo)的m6A和NSUN2介導(dǎo)的m5C甲基化在p21 3'UTR中協(xié)同增強p21翻譯,在氧化應(yīng)激誘導(dǎo)的細(xì)胞衰老中導(dǎo)致p21表達(dá)升高,表明多種RNA甲基化修飾可能協(xié)同調(diào)控同一生物學(xué)事件。然而,仍然需要揭示這些修飾單獨或協(xié)同調(diào)控mRNA表達(dá)過程的更多調(diào)控機制,這將有助于描繪多種RNA甲基化的調(diào)控網(wǎng)絡(luò)。
哺乳動物發(fā)育
配子發(fā)生
一系列最新研究表明,RNA甲基化表觀轉(zhuǎn)錄組在精子發(fā)生和卵子發(fā)生中扮演著至關(guān)重要的角色。Guo等人(2022年)通過LC-MS/MS分析發(fā)現(xiàn),多種RNA修飾(如m5C、m3C、m7G、m2G、m22G、m1G和m1A)分布在人類精子的RNA中,這些修飾在弱精子癥(AZS)和畸精子癥(TZS)組中的水平顯著高于正常精子癥(NZS)組,特別是在TZS組中m5C和m6A的水平更高。在精子發(fā)生過程中,m6A作為一個重要的調(diào)控因子,參與哺乳動物精原細(xì)胞的有絲分裂、減數(shù)分裂和精子形成。Mettl3介導(dǎo)的m6A調(diào)控精原干細(xì)胞(SSCs)的增殖和分化,并影響減數(shù)分裂的啟動。在雄性生殖細(xì)胞中敲除METTL3或METTL14會導(dǎo)致睪丸組織中SSCs快速耗竭甚至完全缺失。人類精子中METTL3上調(diào)導(dǎo)致m6A水平增加,進(jìn)而增強精子運動能力,這是弱精子癥的一個風(fēng)險因素。此外,小鼠支持細(xì)胞特異性敲除Wtap會損害SSCs的自我更新和增殖能力,最終導(dǎo)致不育,通過干擾Wtap介導(dǎo)的m6A修飾基因的可變剪切。此外,ALKBH5介導(dǎo)的小鼠精原細(xì)胞和圓形精子細(xì)胞核中的m6A參與正確剪切和較長3'UTR mRNAs生成,這是精子發(fā)生的晚期減數(shù)分裂和單倍體階段所必需的。敲除FTO會導(dǎo)致GC-1精原細(xì)胞系的染色體不穩(wěn)定和G2/M階段轉(zhuǎn)換抑制。在小鼠中,Ythdc2在雄性或雌性生殖細(xì)胞中敲除導(dǎo)致異常的配子減數(shù)分裂,導(dǎo)致不育和睪丸及卵巢體積減小。同時,小鼠減數(shù)分裂細(xì)胞中條件性敲除Ythdc2導(dǎo)致轉(zhuǎn)錄組嚴(yán)重失調(diào),包括編碼微管網(wǎng)絡(luò)蛋白的轉(zhuǎn)錄本,并導(dǎo)致減數(shù)分裂細(xì)胞和精原細(xì)胞在晚期減數(shù)分裂階段的端粒聚集和凋亡。成年雄性小鼠Ythdc1缺陷導(dǎo)致缺乏任何生殖細(xì)胞,包括有絲分裂精原細(xì)胞,并表現(xiàn)出僅支持細(xì)胞的表型。在小鼠精原細(xì)胞中敲除Ythdf2通過m6A/mRNA降解通路下調(diào)基質(zhì)金屬蛋白酶表達(dá),并影響細(xì)胞粘附和精原細(xì)胞增殖。此外,敲除m5C甲基轉(zhuǎn)移酶NSun2對精原干細(xì)胞和支持細(xì)胞沒有影響,但抑制了生殖細(xì)胞進(jìn)入減數(shù)分裂的減數(shù)分裂階段。
在卵子發(fā)生過程中,METTL3介導(dǎo)的m6A通過促進(jìn)母源mRNA翻譯效率對小鼠卵母細(xì)胞成熟是必需的。在卵母細(xì)胞的生殖泡(GV)階段敲低Mettl3嚴(yán)重抑制卵母細(xì)胞的減數(shù)分裂成熟。同時,Yao等人(2023年)證明METTL3催化的m6A沉積促進(jìn)了GV期卵母細(xì)胞中m6A修飾RNA降解。然而,Mu等人(2021年)報告稱METTL3靶向Itsn2進(jìn)行m6A修飾,隨后增強其在GV階段的穩(wěn)定性,以促進(jìn)卵母細(xì)胞發(fā)育過程中減數(shù)分裂的恢復(fù)。此外,母源YTHDF2負(fù)責(zé)以m6A依賴方式指導(dǎo)適當(dāng)?shù)哪冈崔D(zhuǎn)錄本劑量,從而決定哺乳動物卵母細(xì)胞質(zhì)量和雌性生育能力。卵母細(xì)胞中Ythdc1缺陷導(dǎo)致m6A依賴的可變剪切缺陷,導(dǎo)致卵母細(xì)胞成熟停滯和雌性不孕。在卵母細(xì)胞中特異性敲除KIAA1429導(dǎo)致GV期卵母細(xì)胞中m6A修飾RNA的異常代謝,導(dǎo)致GV卵母細(xì)胞無法進(jìn)行生殖泡破裂(GVBD)和隨后失去恢復(fù)減數(shù)分裂能力。此外,卵巢中Nsun5缺失導(dǎo)致m5C在mRNA外顯子和3'UTR區(qū)域的時間依賴性下降,影響減數(shù)分裂阻滯缺陷2樣2(MAD2L2)的mRNA穩(wěn)定性、生長分化因子9(GDF9)的翻譯效率、以及Brd8外顯子區(qū)域的異常可變剪切,導(dǎo)致卵泡發(fā)育和卵巢功能障礙。有趣的是,NSUN2在人類和小鼠MI/MII期卵母細(xì)胞的細(xì)胞質(zhì)中表達(dá),可能促進(jìn)NSUN2蛋白與母源mRNAs互作,并催化m5C形成。卵母細(xì)胞中m5C修飾轉(zhuǎn)錄本的逐漸增加和沉積可能在早期胚胎發(fā)生中起作用。
早期胚胎發(fā)育
RNA甲基化修飾在胚胎發(fā)育中發(fā)揮重要作用。在體外,小鼠GV期卵母細(xì)胞中METTL3缺失會阻礙受精后胚胎發(fā)育中的母系到合子轉(zhuǎn)變(MZT)和合子基因組激活,可能是通過破壞母源mRNA降解。小鼠胚胎4細(xì)胞階段的轉(zhuǎn)錄因子mRNA上,如Cdx2、Nanog、Sox2和Pou5f1的m6A修飾,可能參與調(diào)控合子基因激活(ZGA)過程。m6A reader蛋白YTHDF2在母源上是必需的,對于卵母細(xì)胞的能力和早期MZT過程,具有清除m6A修飾的母源mRNA作用。由METTL3依賴的m6A甲基化調(diào)控的HnRNPA2/B1在著床前胚胎發(fā)育期間在核和細(xì)胞質(zhì)中表達(dá),其功能缺陷會延緩4細(xì)胞階段后的胚胎發(fā)育,并通過對胚泡中多能性的調(diào)控影響內(nèi)細(xì)胞團(ICM)的形成。斑馬魚胚胎發(fā)生中的m5C reader蛋白YBX1招募Pabpc1a來維持m5C修飾的母源mRNA穩(wěn)定性,促進(jìn)有序的MZT過程。
對于小鼠胚胎干細(xì)胞(mESC),Wang等人報告稱m6A甲基化對于維持mESC在其基礎(chǔ)狀態(tài)至關(guān)重要,Mettl3或Mettl14缺失會導(dǎo)致mESC失去自我更新能力,這是由于HuR-microRNA和m6A介導(dǎo)的RNA穩(wěn)定性通路功能障礙。Zc3h13靶向核中的WTAP、Virilizer和Hakai的成分復(fù)合體上,催化m6A形成,然后促進(jìn)mESC自我更新。Batista等人(2014年)證明小鼠和人類ESC中Mettl3缺失降低了m6A修飾水平,延長分化時Nanog表達(dá),導(dǎo)致促進(jìn)mESC自我更新和抑制mESC分化。此外,Mettl3介導(dǎo)的m6A甲基化維持多能性因子保真和及時下調(diào),調(diào)控小鼠原始多能性解決過程中適當(dāng)?shù)淖V系啟動和分化。Mettl14介導(dǎo)的m6A調(diào)控mRNA表達(dá)和可變剪切,并進(jìn)一步轉(zhuǎn)換為原始多能性到啟動多能性和外胚層分化的小鼠胚胎。更重要的是,METTL14缺失在E6.5和E7.5(胚胎日)導(dǎo)致嚴(yán)重的生長遲緩和異常形態(tài)。
免疫系統(tǒng)發(fā)育
免疫細(xì)胞起源于造血干細(xì)胞(HSCs)分化,其命運對整個免疫系統(tǒng)至關(guān)重要。越來越多的證據(jù)支持RNA甲基化從多個角度調(diào)控HSCs。斑馬魚胚胎中Mettl3缺失抑制了最早的HSPCs生成,通過破壞YTHDF2介導(dǎo)的動脈內(nèi)皮基因 notch1a 和 rhoca 的m6A依賴性mRNA衰變。與斑馬魚中的功能一致,Mettl3-m6A-YTHDF2-Notch軸通路在小鼠HSPCs生成和明確的造血中也顯示出不可或缺和保守的功能。小鼠中階段特異性的Mettl3缺失導(dǎo)致HSCs積累,并因未能通過METTL3介導(dǎo)的m6A甲基化上調(diào)MYC表達(dá)而阻止HSC分化。Cheng等人(2019b)還證明m6A通過調(diào)控MYC mRNA穩(wěn)定性維持HSC對稱。同時METTL14在正常髓系造血過程中表達(dá)下調(diào),并通過正向調(diào)控MYB和MYC mRNA穩(wěn)定性和翻譯,基于m6A方式促進(jìn)HSPCs向髓系細(xì)胞分化。Ythdf2缺失通過促進(jìn)與干細(xì)胞自我更新相關(guān)的轉(zhuǎn)錄因子m6A介導(dǎo)的mRNA穩(wěn)定性,促進(jìn)HSPCs和人類臍帶血(hUCB)HSCs擴增。Mapperley等人(2021年)還報告稱,造血特異性Ythdf2缺失導(dǎo)致m6A修飾和炎癥反應(yīng)相關(guān)轉(zhuǎn)錄本上調(diào),并激活促炎通路,導(dǎo)致淋巴潛能喪失,隨后髓系偏向和HSC擴增。并且老化的Ythdf2缺失HSCs導(dǎo)致多系造血重建失敗。
RNA甲基化通過調(diào)控免疫相關(guān)基因的轉(zhuǎn)錄本代謝參與先天免疫。在巨噬細(xì)胞中,SOCS1作為SOCS家族蛋白之一,參與巨噬細(xì)胞激活的負(fù)反饋回路,通過促進(jìn)目標(biāo)信號蛋白的多泛素化和蛋白酶體降解,以防止壓倒性的全身炎癥,其在巨噬細(xì)胞中對感染的響應(yīng)依賴于METTL14-m6A-YTHDF1軸。METTL3缺失導(dǎo)致m6A介導(dǎo)的mRNA穩(wěn)定性和Irakm高表達(dá),最終抑制TLR(Toll樣受體)信號介導(dǎo)的巨噬細(xì)胞激活。樹突狀細(xì)胞(DCs)作為連接先天和適應(yīng)性免疫反應(yīng)的專業(yè)抗原呈遞細(xì)胞(APCs),對啟動適應(yīng)性免疫反應(yīng)、消除入侵病原體和維持免疫穩(wěn)態(tài)至關(guān)重要。Mettl3催化的mRNA m6A甲基化增強了CD40、CD80和TLR4信號接頭Tirap翻譯,并促進(jìn)DC激活和TLR4/NF-κB信號誘導(dǎo)的細(xì)胞因子產(chǎn)生。此外,NK細(xì)胞中的Ythdf2對IL-15/STAT5信號介導(dǎo)的NK細(xì)胞存活、增殖和效應(yīng)功能是必需的,促進(jìn)NK細(xì)胞的抗腫瘤和抗病毒免疫活性。小鼠腫瘤模型中Mettl3缺失下調(diào)m6A甲基化基因SHP-2表達(dá),可能導(dǎo)致NK細(xì)胞對IL-15刺激應(yīng)答降低,并抑制NK細(xì)胞在腫瘤微環(huán)境中的浸潤和功能。
除了先天免疫,RNA甲基化還參與調(diào)控適應(yīng)性免疫反應(yīng)。Mettl3介導(dǎo)SOCS家族蛋白SOCS1、SOCS3和CISH的m6A形成及其隨后的降解,降低了SOCS家族活性,從而促進(jìn)IL-7介導(dǎo)的STAT5激活和naïve T細(xì)胞的穩(wěn)態(tài)增殖和分化。在Tregs中敲除Mettl3/m6A增加了Socs mRNA表達(dá),從而抑制IL-2-STAT5信號通路,維持Tregs抑制功能。Th17細(xì)胞敲除METTL3可以促進(jìn)SOCS3 mRNA穩(wěn)定性,從而抑制IL-17A和CCR5表達(dá),破壞Th17細(xì)胞分化和浸潤。METTL3介導(dǎo)的m6A穩(wěn)定Tcf7轉(zhuǎn)錄本,允許正常產(chǎn)生TCF-1蛋白及其調(diào)控的T濾泡輔助(Tfh)細(xì)胞調(diào)控因子,促進(jìn)了Tfh細(xì)胞分化、增殖和功能成熟。T細(xì)胞特異性敲除ALKBH5增強了CD4+ T細(xì)胞中m6A修飾水平,并下調(diào)Cxcl2和Ifng的mRNA穩(wěn)定性和蛋白表達(dá),導(dǎo)致CD4+ T細(xì)胞功能和中性粒細(xì)胞招募在自身免疫期間受到抑制。
與m6A相比,關(guān)于其他RNA甲基化修飾在免疫細(xì)胞中的功能機制的研究相對較少。在高同型半胱氨酸血癥(HHcy)誘導(dǎo)的大鼠慢性炎癥疾病模型中,NSun2通過催化m5C形成及其在T淋巴細(xì)胞中促進(jìn)翻譯來介導(dǎo)IL-17A表達(dá)上調(diào)。Yang等人(2023年)還發(fā)現(xiàn)NSun2特別與Th17細(xì)胞轉(zhuǎn)錄因子RoRγt結(jié)合,催化其靶標(biāo)上的RNA m5C形成,包括Il17a和Il17f,從而增強其mRNA穩(wěn)定性。小鼠CD4+ T細(xì)胞中Nsun2缺失特別抑制了Th17細(xì)胞分化,并緩解Th17細(xì)胞誘導(dǎo)的結(jié)腸炎發(fā)病機制。在系統(tǒng)性紅斑狼瘡(SLE)患者的CD4+ T細(xì)胞中,Nsun2表達(dá)和m5C修飾水平下調(diào),高甲基化m5C轉(zhuǎn)錄本主要參與mRNA剪切、穩(wěn)定和翻譯的細(xì)胞因子相關(guān)信號通路,而低甲基化m5C轉(zhuǎn)錄本主要參與翻譯延伸。
總的來說,RNA甲基化修飾廣泛參與生物體的發(fā)育過程,并在配子發(fā)生、胚胎發(fā)生以及胚胎后神經(jīng)和免疫系統(tǒng)發(fā)育等多個功能通路中發(fā)揮關(guān)鍵作用。目前,m6A在發(fā)育研究中的關(guān)注度比其他修飾更多。隨著檢測技術(shù)的進(jìn)步和各種RNA甲基化調(diào)控因子的鑒定,其他甲基化修飾在發(fā)育中的功能分析也可能變得有價值。
癌癥
目前,已有數(shù)百項研究證明RNA甲基化通過直接作用或其調(diào)控元件參與包括癌癥在內(nèi)的多種疾病發(fā)生和發(fā)展的調(diào)控。以下僅總結(jié)一些最新的(過去五年)和尖端的關(guān)于腫瘤發(fā)生中RNA甲基化修飾的研究。越來越多的證據(jù)表明m6A失調(diào)驅(qū)動異常的轉(zhuǎn)錄和翻譯程序,并隨后促進(jìn)疾病或腫瘤的發(fā)生和進(jìn)展,如白血病、肝細(xì)胞癌(HCC)、肺癌(LC)、結(jié)直腸癌(CRC)、乳腺癌、膀胱癌(BC)、胰腺癌(PC)、胃癌(GC)、膠質(zhì)母細(xì)胞瘤。m6A在癌細(xì)胞代謝中發(fā)揮重要作用,包括通過調(diào)控代謝相關(guān)通路,如mTOR、PTEN、MAPK、NF-κB、Wnt信號通路等,或轉(zhuǎn)錄因子,如HIF-1、FOXM1、cMyc、YAP。m6A還參與重塑各種腫瘤免疫,通過調(diào)控免疫細(xì)胞的生存或功能,包括B細(xì)胞、CD8+ T細(xì)胞、CD4+ T細(xì)胞、PD-1+ T細(xì)胞、Treg細(xì)胞、NK細(xì)胞、DC細(xì)胞、巨噬細(xì)胞、中性粒細(xì)胞、嗜酸性粒細(xì)胞和CD4+記憶激活T細(xì)胞的浸潤,以及免疫相關(guān)細(xì)胞因子的表達(dá),如FN-γ、CXCL9和CXCL10。總體而言,m6A影響腫瘤發(fā)生和轉(zhuǎn)移、代謝、免疫逃逸,在診斷和治療方面具有潛在價值。
m5C調(diào)控因子,如NSUN2的甲基轉(zhuǎn)移酶和YBX1的reader蛋白,在腫瘤組織中高表達(dá)。m5Cs在腫瘤組織中也經(jīng)常出現(xiàn)高甲基化,并在致癌通路中富集。NSUN2和YBX1在UCB中靶向HDGF基因3'UTR的m5C,調(diào)控HDGF mRNA穩(wěn)定性并促進(jìn)UCB發(fā)病機制。丙酮酸激酶肌肉同工酶M2(PKM2),作為一種限速的糖酵解酶,參與腫瘤代謝和生長,其mRNA的3'UTR含有m5C位點。ALYREF直接識別PKM2 mRNA并以其m5C依賴性方式促進(jìn)其穩(wěn)定性,從而促進(jìn)糖酵解和膀胱癌的腫瘤發(fā)生。類似的研究還表明,NSUN2介導(dǎo)的食管鱗狀細(xì)胞癌(ESCC)中的m5C高甲基化通過增強LIN28B依賴的GRB2 mRNA穩(wěn)定性,激活致癌的PI3K/AKT和ERK/MAPK信號,促進(jìn)ESCC的起始和進(jìn)展。NSUN2通過以m5C依賴方式上調(diào)TEAD1增強下咽鱗狀細(xì)胞癌(HPSCC)的增殖和侵襲。在HCC中,NSUN2介導(dǎo)的m5C修飾在HCC中明顯高于相鄰非癌組織。m5C通過抑制Ras通路活性并增加HCC細(xì)胞對索拉非尼的敏感性來調(diào)控HCC進(jìn)展,并且m5C修飾的lncRNA H19招募G3BP1致癌蛋白促進(jìn)HCC發(fā)生和發(fā)展。此外,蛋白質(zhì)翻譯后修飾通過修飾RNA甲基化reader蛋白參與調(diào)控m5C靶標(biāo),并影響腫瘤發(fā)生。SIAH1通過泛素化和降解YBX1間接促進(jìn)m5C修飾RNA不穩(wěn)定性,抑制上皮卵巢癌細(xì)胞的增殖、侵襲、遷移和藥物抗性。
幾項研究表明m7G tRNA修飾影響癌癥進(jìn)展。METTL1/WDR4敲除破壞m7G tRNA解碼密碼子形成,降低mRNA翻譯效率并抑制肺癌、HCC、BC和鼻咽癌(NPC)進(jìn)展。METTL1介導(dǎo)的HeLa細(xì)胞中mRNA內(nèi)部m7G也增強其靶標(biāo)mRNA的翻譯效率,而不依賴其對全局翻譯和tRNA甲基化的影響。METTL1催化的人類臍靜脈內(nèi)皮細(xì)胞中VEGFA mRNA上的m7G組裝增加了VEGFA翻譯,并促進(jìn)缺血后血管生成。這些研究表明內(nèi)部m7G可能參與癌癥進(jìn)展。
總體而言,RNA甲基化修飾在腫瘤發(fā)生過程中發(fā)揮著關(guān)鍵作用,但不同修飾是否在腫瘤發(fā)生中協(xié)同或拮抗作用值得進(jìn)一步研究。此外,盡管許多由RNA甲基化修飾調(diào)控的靶標(biāo)和通路具有腫瘤診斷和治療的潛力,但實際應(yīng)用于臨床設(shè)置很少,需要進(jìn)一步深入研究以促進(jìn)臨床應(yīng)用。
結(jié)論與展望
本文總結(jié)了包括m6A、m5C和m7G在內(nèi)的三種甲基化表觀轉(zhuǎn)錄組的調(diào)控元件、分布特征、檢測技術(shù)以及生物學(xué)功能。由于RNA甲基化修飾在調(diào)控多種生理功能中的參與,主要概述了幾個熱點話題,包括配子發(fā)生、早期胚胎發(fā)生、免疫系統(tǒng)發(fā)育和疾病。盡管m6A和m5C RNA修飾的調(diào)控元件已經(jīng)被發(fā)現(xiàn)并廣泛研究,但關(guān)于其他RNA甲基化修飾的信息相對較少,特別是其erasers和readers需要確定。隨著對其他RNA甲基化修飾動態(tài)性質(zhì)的調(diào)控元件和機制的深入研究,對其功能機制的更清晰理解將有助于建立整體RNA表觀遺傳修飾調(diào)控網(wǎng)絡(luò)。
盡管已經(jīng)開發(fā)了各種RNA甲基化修飾的測序技術(shù),但它們中的大多數(shù)只能很好地捕獲和分析高豐度而不是低豐度轉(zhuǎn)錄本中的修飾信息,而后者將是一個有意義的突破點。此外,越來越多的研究表明RNA甲基化修飾參與多種生物過程和腫瘤發(fā)生。然而,幾乎所有的研究都是在群體細(xì)胞水平上進(jìn)行的,這可能會忽視或扭曲單個細(xì)胞中的真實信息,限制對精確調(diào)控機制的理解,這對于指導(dǎo)疾病的精確靶向治療可能至關(guān)重要。因此,開發(fā)高通量單細(xì)胞RNA甲基化技術(shù)應(yīng)該是該領(lǐng)域的創(chuàng)新點和推動力。此外,幾項研究也表明多種RNA甲基化修飾可能共同調(diào)控某些生物過程。因此,探索不同RNA修飾之間的相互調(diào)控關(guān)系可能是未來的一個熱點話題,這對于構(gòu)建整體RNA表觀遺傳修飾調(diào)控網(wǎng)絡(luò)是必要的。目前能夠同時捕獲多種修飾的測序技術(shù)仍然相對較少,修飾類型的覆蓋范圍和靈敏度仍需改進(jìn)。因此,開發(fā)新技術(shù)以同時檢測多種RNA表觀遺傳修飾是理解生物系統(tǒng)中整體作用模式的必要條件。
從文章的疾病部分來看,RNA表觀遺傳修飾及其調(diào)控因子在各種腫瘤的增殖、侵襲和遷移中發(fā)揮重要作用。此外,多個RNA甲基化修飾基因或其通路已被報道作為診斷或治療的潛在靶標(biāo),但其目前的臨床應(yīng)用仍然非常有限。因此,需要加強特定RNA甲基化修飾抑制劑的研究,這可能是實現(xiàn)RNA甲基化修飾臨床轉(zhuǎn)化應(yīng)用的關(guān)鍵點,盡管已有一些抑制劑的報道,如FTO抑制劑、Meclofenamic酸、FB23/FB23-2、MA2、Entacapone、DAC51、R-2HG、CS1/CS2、METTL3抑制劑(包括Compound 2/Compound 7)、STM2457、YTHDF2抑制劑(包括DC-Y13-27)和IGF2BP1抑制劑(包括BTYNB)。此外,幾項研究表明RNA甲基化修飾可以用于靶向編輯。在細(xì)胞水平上,表達(dá)與截短的METTL3甲基轉(zhuǎn)移酶結(jié)構(gòu)域融合的核定位dCas13,與修飾的METTL3-METTL14甲基轉(zhuǎn)移酶復(fù)合體和特定導(dǎo)向RNA融合的細(xì)胞質(zhì)定位,有能力在mRNA中將特定位點的腺苷修飾為m6A。Liu等人(2019b年)還設(shè)計了一個m6A動態(tài)編輯系統(tǒng),將CRISPR-Cas9與單鏈m6A甲基轉(zhuǎn)移酶METTL3:METTL14融合以在特定位點編程m6A形成,同時將CRISPR-Cas9與ALKBH5或FTO融合以實現(xiàn)RNA的位點特異性去甲基化。然而,這些技術(shù)都是基于細(xì)胞內(nèi)編輯相關(guān)蛋白的表達(dá),使得直接治療如人類腫瘤等疾病變得困難,而其他RNA甲基化的RNA編輯技術(shù)大多未知。此外,考慮到RNA甲基化修飾對mRNA代謝和翻譯有顯著影響,研究體外RNA甲基化靶向編輯技術(shù)對于增強mRNA藥物的效力具有重要意義。
總之,對RNA甲基化修飾的調(diào)控蛋白組分、測序技術(shù)、功能機制、抑制劑和靶向編輯技術(shù)的深入研究將提供關(guān)于RNA甲基化修飾在生物發(fā)育和疾病發(fā)生中功能角色的廣闊視野,對于疾病診斷和治療也具有寶貴的視角。
標(biāo)簽:
RNA甲基化
- DNA甲基化技術(shù)助力揭示IRF1在創(chuàng)傷性顱腦損傷中的表觀調(diào)控機制
- Stereo-seq揭示小鼠耳廓再生關(guān)鍵基因破解哺乳動物再生能力丟失之謎
- 血漿ChIP-seq的cfDNA組蛋白修飾分析揭示晚期前列腺癌表型異質(zhì)性
- cfDNA甲基化模式追溯肝臟移植后同種異體移植物損傷的細(xì)胞來源
- 微量WGBS等揭示有袋類和真獸類動物胚胎中DNA甲基化動態(tài)差異
- ChIP-seq助力揭示AcP依賴性乙酰化修飾網(wǎng)絡(luò)對放線菌穩(wěn)態(tài)的調(diào)控機制
- ChIP-seq揭示組蛋白甲基轉(zhuǎn)移酶NSD2在炎癥性腸病發(fā)生過程中的表觀調(diào)控
- 微量轉(zhuǎn)錄組測序揭示TET酶在動物卵母細(xì)胞成熟和孤雌胚胎發(fā)育中的作用
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com