Stereo-seq揭示小鼠耳廓再生關鍵基因破解哺乳動物再生能力丟失之謎
壁虎斷尾重生,蠑螈大腦自愈……我們常感嘆,人類為什么沒有這樣的“超能力”?其實,在哺乳動物中,像兔子、山羊等也具備一定的再生能力。而人類、小鼠這類高等哺乳動物受傷后,往往只能結疤愈合,無法“原裝”再生。為什么高等哺乳動物在進化過程中丟失了這些能力?這是生物學界的一大謎題。
最近,科學家們在小鼠和兔子的“耳朵”上找到了關鍵線索!
北京時間6月27日,北京華大生命科學研究院聯合北京生命科學研究所,基于華大自主研發的時空組學技術Stereo-seq和高通量測序平臺DNBSEQ-T10,首次發現Aldh1a2基因的表達不足導致的視黃酸合成不足是高等哺乳動物小鼠耳廓再生失敗的核心機制。在激活該基因后,小鼠耳廓實現再生!這為深入理解進化過程中哺乳動物的再生能力丟失提供了新的見解,并為再生醫學和人類受損器官的重建與再生提供了重要靶標。相關成果發表于國際頂級學術期刊Science。
文章頁面截圖
01 小鼠耳廓為何不能再生?關鍵在這個基因
研究團隊選取了哺乳動物特有器官耳廓(外耳)為研究模型,基于單細胞RNA測序和華大自主研發的時空組學技術Stereo-seq,描繪了可再生物種(兔子)與不可再生物種(小鼠)耳廓損傷后再生/修復的高分辨率單細胞時空動態過程,逐時逐步觀察傷口處每個細胞類型的變化和基因表達動態,精確對比再生過程和普通愈合過程有何不同。
結果發現,小鼠耳廓再生失敗與視黃酸合成不足有關。視黃酸是維生素A的一種代謝產物,與細胞發育密切相關。而小鼠視黃酸不足主要是因為視黃酸合成限速酶Aldh1a2的表達不足,以及視黃酸本身的降解加速。
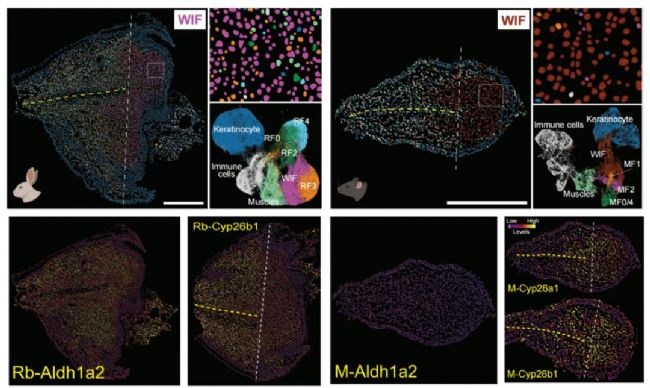
兔子耳廓再生與小鼠耳廓修復過程中視黃酸的合成和降解
02 關鍵基因“開關”的進化丟失
為什么小鼠的Aldh1a2基因表達會不足呢?科研團隊通過進化生物學比較發現,在兔子的基因組中,保留了負責調控Aldh1a2基因的一些關鍵DNA序列。這些調控序列被稱為“增強子”,可以理解為基因表達的開關或加速器。研究人員在兔子Aldh1a2基因附近發現了6個活躍的增強子(AE1~AE6),其中有兩個增強子(AE1和AE5)在耳廓受傷再生時會被強烈激活,相當于在兔子受傷后及時按下“開關”,大大提高了Aldh1a2的表達,在兔子傷口處源源不斷地產生視黃酸,幫助組織再生。
可惜的是,研究團隊僅在小鼠對應的基因區域找到了1個活性增強子(AE3),其它與再生相關的調控元件都已失活。換句話說,小鼠體內調控Aldh1a2基因的“按鈕”大都消失了,受傷后想要大幅度開啟Aldh1a2基因表達非常困難。這一進化差異解釋了為什么小鼠耳廓受傷后Aldh1a2“叫不醒”、視黃酸產量提不高,從而無法像兔子那樣再生組織。
03 激活關鍵基因,小鼠耳廓再生
問題來了,如果人為按下這些丟失的“開關”,是否就能讓失去再生能力的動物實現再生呢?研究團隊進行了探索:他們嘗試直接激活Aldh1a2基因或外源補充視黃酸,發現都可以使本不具備再生能力的成年小鼠耳廓傷口,出現了多能性細胞(成纖維細胞),從而重建了耳廓的軟骨與神經組織。也就是說,小鼠耳朵的傷口不再只是簡單結疤,而是實現了再生!
此外,研究團隊還將兔子的增強子AE1導入小鼠的基因組,結果發現,受傷后的小鼠耳廓Aldh1a2基因表達顯著提高,視黃酸增加,耳廓的再生能力也得到明顯提升。
總而言之,研究團隊基于單細胞時空組技術以及跨物種進化比較,系統描繪了器官損傷后,可再生物種與不可再生物種的細胞組成變化以及基因表達的時空動態變化,全面揭示了高等哺乳動物器官再生能力丟失的機制,為探索人類受損器官的重建與再生提供了重要靶標和理論依據。
北京生命科學研究所林煒鋒博士研究生、賈小慧博士研究生、北京華大生命科學研究院石小峰副研究員、西北農林科技大學赫秋亞副教授、北京華大生命科學研究院張盼玉助理研究員為論文共同第一作者。北京生命科學研究所王偉研究員、北京華大生命科學研究院鄧子卿研究員和西北農林科技大學羅軍教授為論文共同通訊作者。該研究得到了國家重點研發計劃項目的資助,也獲得了北京生命科學研究所倫理審查委員會和華大科技倫理委員會的批準。
時空組學產品方案全方位賦能再生研究
華大時空組學技術Stereo-seq,憑借高分辨率空間定位、單細胞水平分析等優勢,為開展再生研究提供了有力工具。早前,華大時空組學技術已助力研究人員成功構建了首個蠑螈端腦發育及再生的時空單細胞轉錄組圖譜、首個斑馬魚心臟再生全過程高分辨率時空圖譜、小鼠肝臟穩態及再生模型的時空轉錄圖譜等。
依托Stereo-seq,華大時空組學推出了適用于新鮮冷凍樣本的時空轉錄組FF V1.3、適用于石蠟包埋樣本的時空轉錄組FFPE、適用于大尺寸組織的時空轉錄組大尺寸芯片,以及時空蛋白轉錄組Stereo-CITE等產品解決方案,幫助科研人員進一步提升研究的廣度與深度。