文獻解讀:腫瘤新生抗原的發現與在免疫治療中的應用
一、研究背景
1988年,De Plaen研究團隊發現,在小鼠P815腫瘤模型中,來源于腫瘤體細胞突變產生的多肽可被T細胞所識別,證實了腫瘤新生抗原(Neoantigen)的存在[1]。腫瘤新生抗原是一類腫瘤特異性抗原,由腫瘤細胞基因突變而產生,并且可在細胞表面表達、加工和呈現,隨后在主要組織相容性復合物(major histocomp atibility complex, MHC)分子的作用下被T細胞識別,從而激活機體的免疫系統,引起一系列免疫應答反應。新生抗原來自腫瘤細胞中突變基因的表達,并不存在于正常的組織細胞中,因此可以引發真正的腫瘤特異性T細胞免疫反應,避免對非腫瘤組織造成“脫靶”損傷。這些特點使得腫瘤新生抗原成為基于T細胞的腫瘤免疫治療的理想靶點,具有廣泛的治療前景和臨床應用價值。
二、腫瘤新生抗原的來源
De Plaen及其同事當年在小鼠腫瘤模型中所發現的第一個新生抗原,其腫瘤突變基因與正常基因相比只有一個核苷酸不同,這個單核苷酸的突變產生了一個氨基酸的變化,從而產生可被特異性T細胞識別的突變肽。從2012年開始,高通量測序技術被廣泛應用,進一步證明了腫瘤新生抗原可以從各種來源獲得,目前可分為以下5類:
1.基因組變異
包括單核苷酸變異(single-nucleotide variations, SNVs)和插入/缺失突變(insertions and deletions, Indels)。腫瘤細胞的遺傳不穩定常導致大量突變,非同義突變編碼蛋白產生的變異肽可能通過MHC分子呈遞到腫瘤細胞表面,形成腫瘤新生抗原,這種SNVs突變是腫瘤中最常見的基因組水平突變類型。Indels是指處于外顯子區域的堿基發生移碼突變,從而形成一個新的開放閱讀框,并可能產生大量與自身高度不同的腫瘤新生抗原。盡管Indels的發生頻率比SNVs低,但前者產生的新生抗原卻往往更具免疫原性。
2.基因融合
與正常組織細胞相比,腫瘤細胞大多數會發生基因組的結構變異,包括倒位、缺失、重復和易位等。其中由基因組發生易位導致的基因融合會改變閱讀框,最終形成腫瘤新生抗原。
3.轉錄組選擇性剪接
選擇性剪接也是腫瘤新生抗原的重要來源。細胞維持基因組編碼產生蛋白多樣性的一種常見機制就是轉錄組的選擇性剪接,通過這種方式,基因的特定外顯子可能被排除在成熟的mRNA之外或保留特定內含子,從而導致蛋白質多樣性增加。
4.RNA編輯
RNA編輯是一種常見的轉錄后修飾,可以改變RNA序列中的特定核苷酸,也可以導致非同義替換,從而產生新的蛋白質。通過這種方式,腫瘤蛋白質組的多樣性大大提高,從而形成大量的腫瘤新生抗原。
5.轉錄組非編碼區突變
來自非編碼區的突變也可成為腫瘤新生抗原的來源。有研究表明,許多非編碼區其實也具有編碼蛋白質的能力,突變后產生的多肽可被MHC分子所遞呈,并可被免疫系統所識別。
三、腫瘤新生抗原的預測
腫瘤體細胞突變的來源非常廣泛,我們必須對這些突變序列進行預測,篩選出最能夠特異性引起機體免疫應答反應的候選新生抗原,這也是個性化腫瘤免疫治療中極為關鍵的環節。
首先在得到患者的腫瘤組織后,可以通過高通量測序技術初步識別腫瘤體細胞的突變序列,再借助AI算法和質譜技術預測潛在的腫瘤新生抗原,在這一過程中需要考慮很多因素,包括HLA分型、TCR結合力、MHC親和力、腫瘤新抗原來源等;還包括用來評估T細胞反應的相關因素,如T細胞識別、TCR分析和免疫細胞分析等。基于機器學習和人工智能技術的預測算法需要使用驗證性數據集進行持續訓練,其中數據類型、質量和數量都會極大地影響算法的精度。因此,數據庫的不斷積累,尤其是經過驗證的腫瘤新抗原數據,對于提高算法的準確性極為關鍵。
四、腫瘤新生抗原在免疫治療中的應用
基于腫瘤新生抗原的免疫活性,其在免疫治療領域的應用策略有以下幾種:
1.個性化新生抗原疫苗
腫瘤新生抗原在免疫治療中最主要的應用即開發個性化的新生抗原疫苗。主要流程為:首先從患者身上獲取腫瘤組織和正常組織樣本,通過高通量測序技術鑒定出腫瘤的突變基因,再利用AI算法同時結合質譜技術分析預測出最有可能成為腫瘤新抗原的基因序列,然后經濕實驗驗證后,最終設計出針對新生抗原的的腫瘤疫苗。疫苗的形式多樣,包括多肽疫苗、核酸(DNA/mRNA)疫苗和樹突狀細胞(DC)疫苗等,每種劑型都有各自的優缺點。
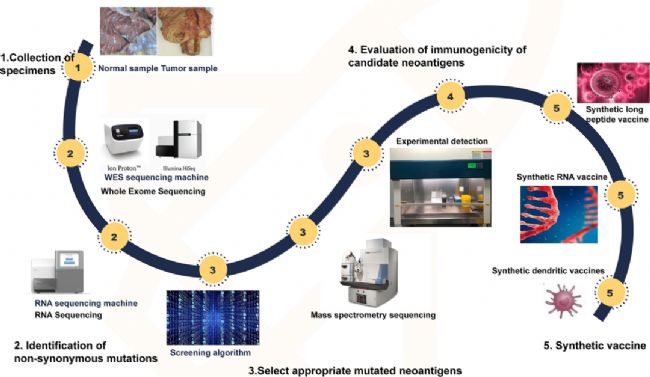
圖1 研制個性化新生抗原疫苗的流程[2]
2015年,Carreno團隊在其研究中給3名晚期黑色素瘤患者接種了基于樹突狀細胞(DC)的個性化疫苗,這也是首個使用新生抗原疫苗的人類臨床試驗,其結果證明DC疫苗激活了患者體內的特異性T細胞,增強了機體的抗腫瘤免疫反應[2]。隨后nature期刊又報道了一項用于治療高危黑色素瘤的個性化多肽新抗原疫苗研究(圖2a),I期臨床試驗評估結果顯示,針對之前未經治療的高危黑色素瘤(IIIB/C期和 IVM1a/b期)患者,在手術切除后進行疫苗接種,達到了治愈的效果(圖2b)。
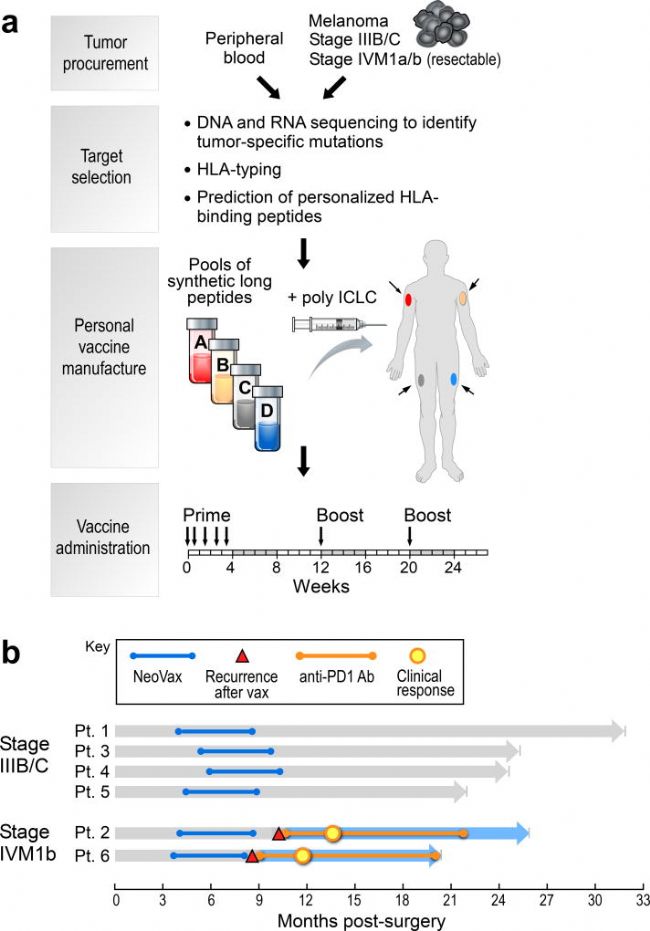
圖2 針對高危黑色素瘤患者設計的個性化多肽新抗原疫苗[3]
2.基于新抗原的過繼細胞療法
例如在TCR-T療法中,可以對外周血T細胞的TCR進行基因改造,引導其識別某些新抗原,以提高靶向腫瘤細胞的特異性。在基于TIL療法的臨床試驗中,通過在體外擴增對腫瘤新生抗原有特異性反應的T細胞,再回輸到轉移性黑色素瘤患者體內,其病情在十多年內達到完全緩解。
3.新抗原與其他藥物聯合治療
臨床上也在嘗試將腫瘤新生抗原與其他療法如免疫檢查點抑制劑(如PD-1/PD-L1/CTLA-4)聯合使用,防止免疫逃逸,提高臨床治療療效。此外,放療、化療等傳統治療方法也可以增強新生抗原疫苗的作用。
五、總結
盡管基于腫瘤新生抗原的免疫療法在臨床試驗中已顯示出明顯的治療效果,但其發展仍面臨許多挑戰,如:尋找更有效的抗原、改進預測新抗原的篩選方法、開發不同腫瘤疫苗的遞送技術等等。當然,隨著越來越多基礎研究和臨床試驗的展開,我們有理由相信,基于腫瘤新生抗原的療法仍然是癌癥免疫療法中很有前景的領域。
參考文獻:
[1]de Plaen E, Lurquin C, van Pel A, et al. Immunogenic (tum-) variants of mouse tumor P815: cloning of the gene of tum- antigen P91A and identification of the tum- mutation[J]. Proc Natl Acad Sci USA, 1988, 85(7): 2274-2278.
[2]Zhang Z, Lu M, Qin Y, et al. Neoantigen: A New Breakthrough in Tumor Immunotherapy. Front Immunol. 2021;12:672356. Published 2021 Apr 16. doi:10.3389/fimmu.2021.672356.
[3]Carreno BM, Magrini V, Becker-Hapak M, et al. Cancer immunotherapy. A dendritic cell vaccine increases the breadth and diversity of melanoma neoantigen-specific T cells. Science. 2015;348(6236):803-808. doi:10.1126/science.aaa3828.