顛覆傳統觀點的研究:衣康酸一體兩面,兼具抗炎與促炎功能的雙重機制
2025 年 6 月 16 日,同濟大學大學附屬東方醫院呼吸與危重癥醫學科王飛龍、李強、郭忠良團隊在Cell Metabolism在線發表題為“Itaconate promotes inflammatory responses in tissue-resident alveolar macrophages and exacerbates acute lung injury”的研究論文。
該研究揭示了衣康酸在肺泡巨噬細胞(AMs)中的獨特作用:與BMDMs中的抗炎效應相反,衣康酸在AMs中促進促炎細胞因子產生并增強NLRP3炎癥小體激活。
南模生物為該研究提供了Itgax-2A-tdTomato-2A-DTR(目錄號:NM-KI-204992)小鼠。

衣康酸(Itaconate)是TCA循環的中間產物,由免疫應答基因1(IRG1)編碼的烏頭酸脫羧酶(ACOD1)催化順烏頭酸脫羧產生。在炎癥反應過程中(內毒素LPS等刺激下),巨噬細胞ACOD1表達上調,促進順烏頭酸向衣康酸的轉化。
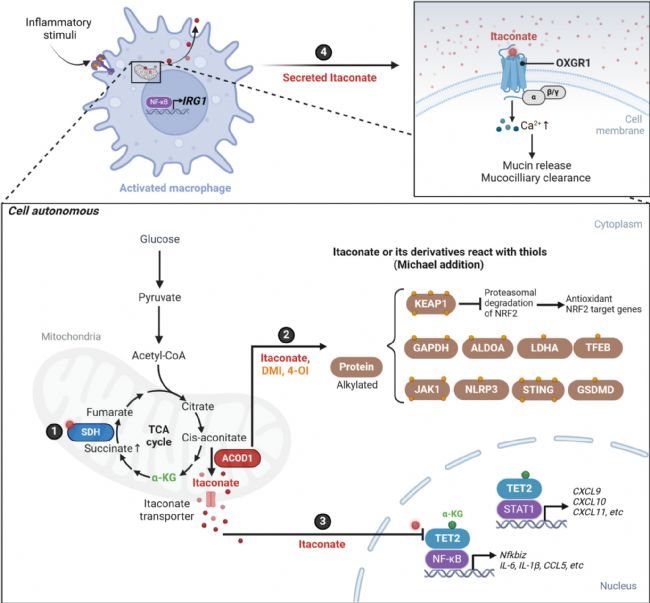
圖1. 衣康酸(ITA)的作用靶點及作用機制 [1]
為明確這一問題,王飛龍/李強/郭忠良團隊進行了以下研究:
1 Toll樣受體4的激活在AMs中誘導IRG1的表達和衣康酸的產生
為探究衣康酸在肺泡巨噬細胞(AMs)免疫調節中的作用,研究者首先驗證了Toll樣受體4(TLR4)通路是否可通過誘導IRG1表達而啟動衣康酸的合成。結果顯示,LPS處理后Irg1 mRNA水平相較對照組升高約300倍(圖1A),RNA-seq數據亦表明Irg1是LPS刺激下表達上調最顯著的基因之一(圖1B)。進一步通過蛋白水平分析驗證了IRG1在LPS刺激后顯著表達(圖1C)。
為進一步明確AMs是否能合成并分泌衣康酸,作者對細胞內及培養基上清中的衣康酸進行了定量分析。結果表明,LPS刺激可誘導AMs細胞內衣康酸合成(圖1D),同時衣康酸也被分泌到上清液中,表現為刺激后衣康酸水平隨時間升高(圖1E)。相比骨髓來源巨噬細胞(BMDMs),LPS處理后AMs產生的衣康酸水平更高(圖1F)。
AMs的代謝和功能特性受肺氣道和肺泡微環境(包括其中的代謝物)嚴格調控。為評估LPS刺激是否會誘導氣道中衣康酸的產生(這可能對調控AMs代謝和免疫功能起重要作用),作者對小鼠進行氣管內滴注LPS以誘導急性炎癥性肺損傷,隨后收集支氣管肺泡灌洗液(BALF)以檢測體內衣康酸的水平。結果表明,LPS處理后BALF中的衣康酸含量顯著高于對照組(圖1G),Irg1 mRNA與蛋白表達均顯著升高(圖1H, 1I)。以上結果表明,LPS刺激在體內上調AMs 中Irg1的表達,并增加LPS誘導的急性肺損傷中氣道中的衣康酸水平。
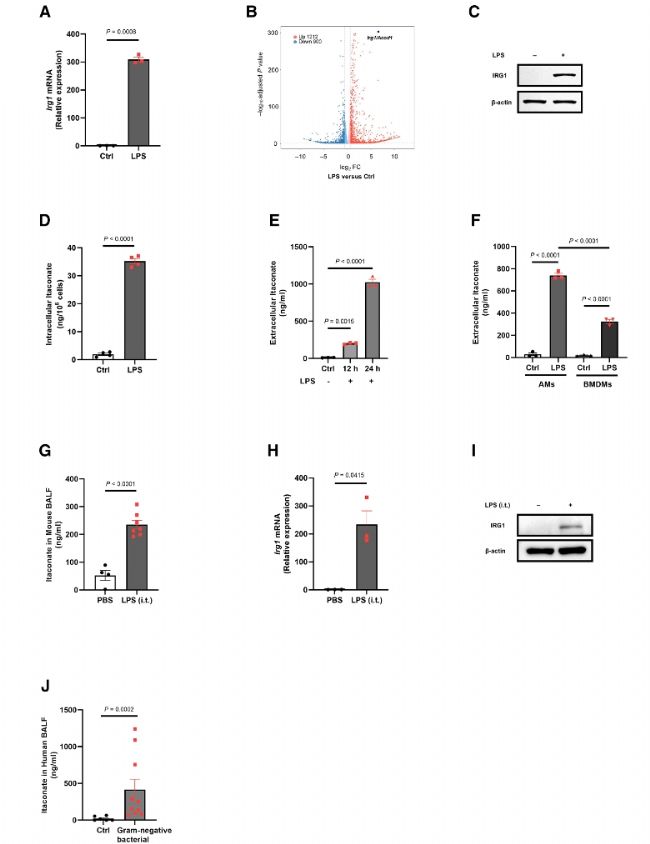
Fig1. Toll樣受體4的激活在AMs中誘導IRG1的表達和衣康酸的產生
2 衣康酸促進肺泡巨噬細胞中炎性細胞因子的產生
AMs在體外和體內受到LPS刺激時,與BMDMs類似地誘導Irg1表達并合成衣康酸,但衣康酸在AMs中的免疫調節功能是否同樣具備抗炎作用還尚未可知。作者首先在BMDMs中證實了衣康酸的經典作用:預處理衣康酸可顯著抑制LPS誘導的促炎因子IL-6和IL-12表達(圖2A、2B)。然而,在AMs中,作者卻發現衣康酸在多種濃度作用下IL-6和IL-12分泌增強,且具有劑量依賴性(圖2C和2D),TNF-α水平并無未受到顯著影響(圖2E)。此外,作者發現該相反的效果與細胞活力無關(圖2F和2G)。
為進一步分析衣康酸對AMs激活的影響,作者對經預處理和未經預處理的AMs在LPS刺激后進行了RNA測序分析。結果表明,衣康酸處理組AMs中,IL-6、IL-12、IL-1β、IL-18等多種促炎因子以及CXCL1、CXCL2、CXCL3和CXCL10等趨化因子的表達水平顯著升高(圖2H和2I)。GO功能注釋進一步表明,LPS+衣康酸處理組中差異表達基因高度富集于與免疫應答相關的生物過程(圖2K)。以上結果提示,衣康酸在AMs中具有促炎作用,該特性與其在BMDMs中的抗炎作用相反。
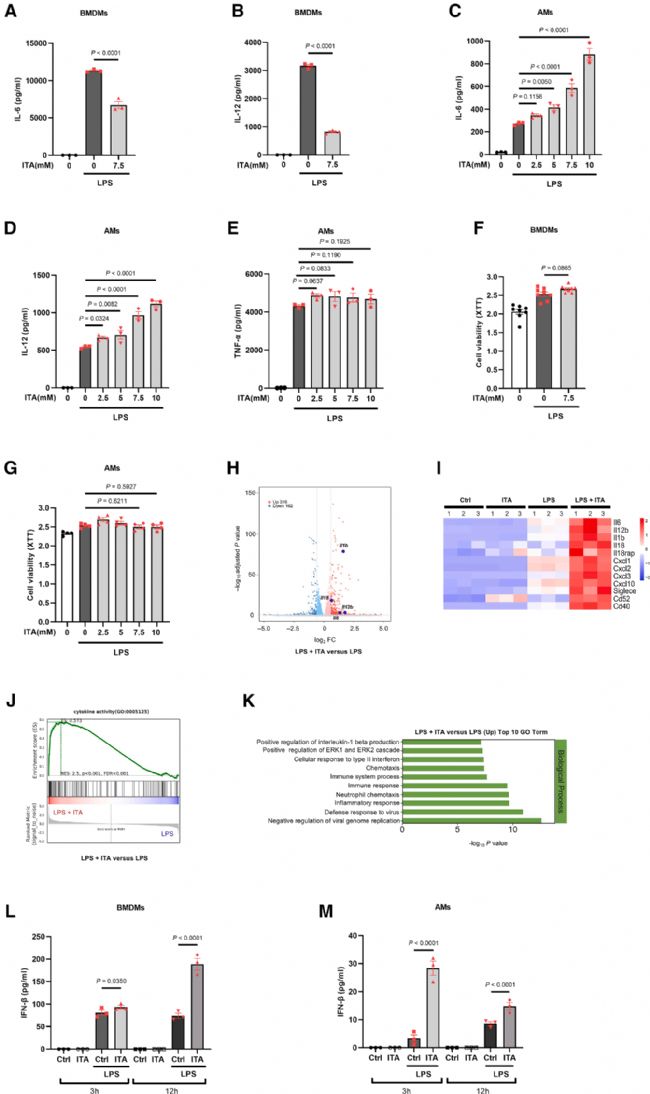
Fig2. 衣康酸促進肺泡巨噬細胞中炎性細胞因子的產生
3 衣康酸促進肺泡巨噬細胞中NLRP3炎癥小體的激活
以往研究表明,衣康酸除抑制IL-6和IL-12的表達外,還可抑制BMDM中NLRP3炎性蛋白質體的激活。衣為進一步探究衣康酸是否會促進肺泡巨噬細胞中NLRP3炎癥小體的激活,作者采用衣康酸預處理聯合LPS加ATP刺激的方法。結果表明,在BMDMs中,衣康酸處理抑制了NLRP3炎癥小體激活的終末產物——成熟IL-1β的產生(圖3B),而在AMs中,衣康酸顯著增強了IL-1β的成熟與分泌,并且具有劑量依賴性(圖3C),提示衣康酸對AMs的促炎作用比促進IL-6和IL-12的產生更廣泛。
在NLRP3炎癥小體通路中,成熟IL-1β的生成主要受兩個信號步驟控制:第一個為原IL-1β的誘導表達(priming,信號1),第二個為炎癥小體的激活并介導其剪切成熟(activation,信號2)。為明確了衣康酸如何通過影響這兩個信號來增強成熟IL-1β的生成,作者進行了進一步的研究。結果表明,僅在較高劑量下,衣康酸才能促進AMs中原IL-1β(pro-IL-1β)表達(圖3D),與較低劑量誘導的成熟 IL-1β 產生增加不成比例(圖3C),提示其主要作用可能集中在激活步驟。為驗證這一假設,作者使用表達熒光融合蛋白的AMs(ASC-citrine)進行可視化檢測,以監測ASC寡聚體斑點(ASC speck)的形成,后者是NLRP3炎癥小體激活過程中的關鍵事件。結果表明,衣康酸顯著促進NLRP3介導的ASC寡聚化。同時,Western blot結果也表明,衣康酸可增強caspase-1與GSDMD的剪切,分別形成其活性片段p10及GSDMD-N-terminal(圖3F)。以上結果提示,衣康酸通過促進炎癥小體激活而增強IL-1β成熟與釋放。
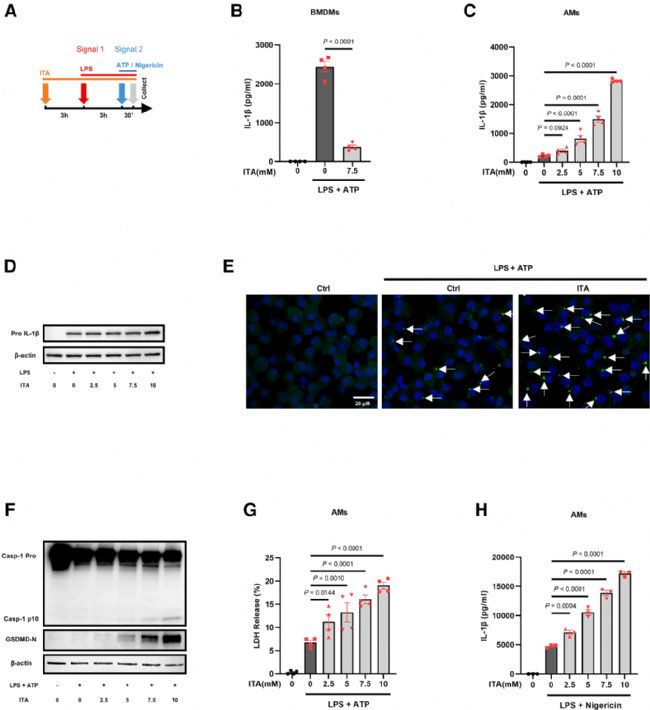
Fig3. 衣康酸促進肺泡巨噬細胞中NLRP3炎癥小體的激活
4 內源性衣康酸增強AMs中NLRP3炎癥小體的激活
在前面的研究中,作者發現外源添加衣康酸可促進肺泡巨噬細胞(AMs)的促炎反應,那是否AMs自身合成的內源性衣康酸也具有相同作用呢?作者對此進行了進一步探究,結果顯示,在LPS刺激3小時后,WT AMs產生大量衣康酸,而Irg1-/- AMs幾乎不產生衣康酸且成熟IL-1β較少,說明IRG1是AMs中衣康酸合成所必需的(圖4A)。同時,外源補充衣康酸可恢復Irg1-/- AMs中IL-1β的產生(圖4D和4E)。進一步證明內源衣康酸可促進NLRP3炎癥小體的激活。
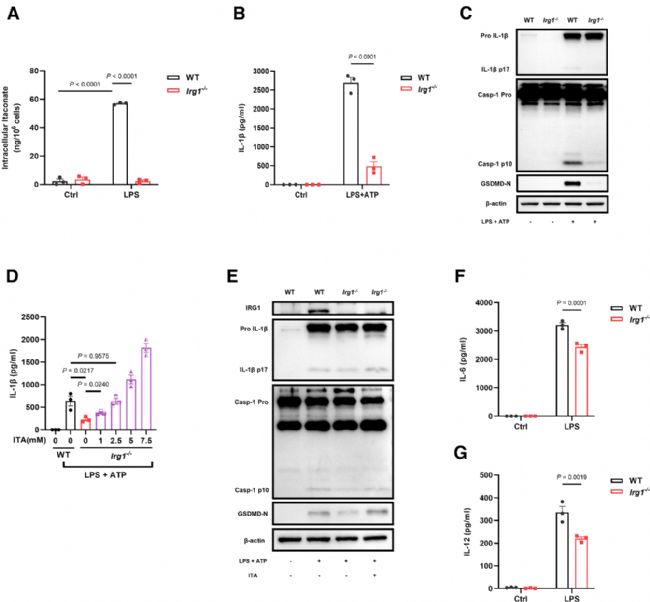
Fig4. 內源性衣康酸增強AMs中NLRP3炎癥小體的激活
5 衣康酸的促炎活性不依賴于NRF2與GSDMD通路,而與SDH抑制密切相關
為進一步闡明衣康酸在AMs中誘導促炎反應的分子機制,研究者首先檢測了轉錄因子NRF2(nuclear factor erythroid 2-related factor 2)介導的抗氧化通路。結果發現,在NRF2缺失(Nrf2-/-)的AMs中,衣康酸仍能顯著增強LPS誘導的IL-6與IL-12表達(圖5A、5B),并促進NLRP3炎癥小體激活(圖5C),表明該促炎作用并不依賴于NRF2信號通路。進一步探究表明,衣康酸在AMs中的促炎作用可能主要源于其對SDH活性的抑制,而非通過NRF2或GSDMD通路。
鑒于衣康酸在AMs中呈現促炎效應,而在BMDMs中則表現為抗炎作用,作者推測AMs對衣康酸的特殊響應可能源自其所處的肺泡微環境。為驗證這一點,作者觀察了AMs在不同體外培養時長下對衣康酸的應答。結果發現,在LPS+ATP刺激下,AMs在分離后24小時內仍能顯著響應衣康酸促進IL-1β產生,但這一效應在體外培養3天后明顯減弱,7天后基本消失(圖5P、5Q),提示AMs對衣康酸的促炎作用依賴于體內肺泡環境。
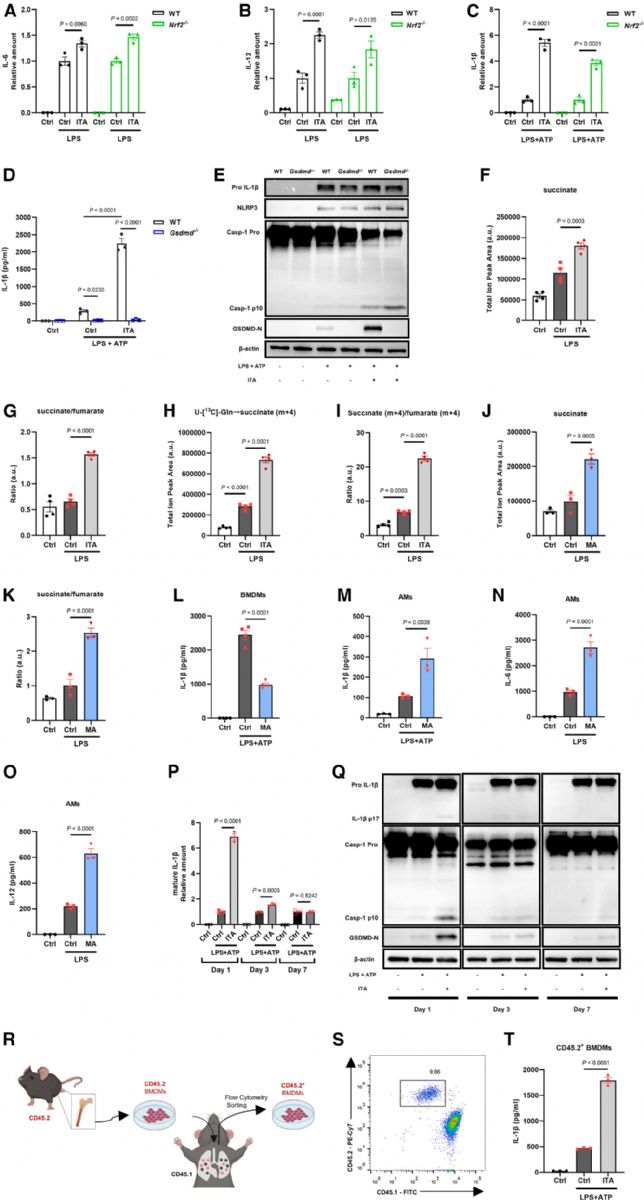
Fig5. 衣康酸的促炎活性不依賴于NRF2與GSDMD通路,而與SDH抑制密切相關
6 衣康酸通過增強線粒體電子傳遞鏈復合物I(ETC-CI)活性促進AMs中的炎癥反應
為探究衣康酸在肺泡巨噬細胞(AMs)中促炎作用的代謝機制,作者對移植前后的CD45.2+ BMDMs進行了單細胞RNA測序。結果顯示,移植至肺泡腔的BMDMs氧化磷酸化(OXPHOS)通路呈顯著正相關,提示肺泡微環境促使巨噬細胞依賴OXPHOS以適應低葡萄糖環境。代謝分析進一步表明,AMs在LPS刺激下仍維持OXPHOS,不發生糖酵解轉移,且乳酸水平不變,但TCA中間產物積累,顯示其代謝特征與BMDMs不同。
衣康酸可抑制琥珀酸脫氫酶(SDH),而SDH是線粒體呼吸鏈的重要組分。結果發現,衣康酸處理未降低AMs的基礎耗氧速率(OCR),反而提高ATP水平,提示其通過增強電子傳遞鏈復合物I(ETC-CI)活性維持能量代謝。RNA-seq和代謝分析支持這一假設,表明衣康酸可增強ETC-CI介導的呼吸活性。使用ETC-CI抑制劑Piericidin A可顯著降低AMs的OCR,并抑制IL-1β和IL-6的產生,說明ETC-CI在衣康酸介導的促炎反應中起關鍵作用。
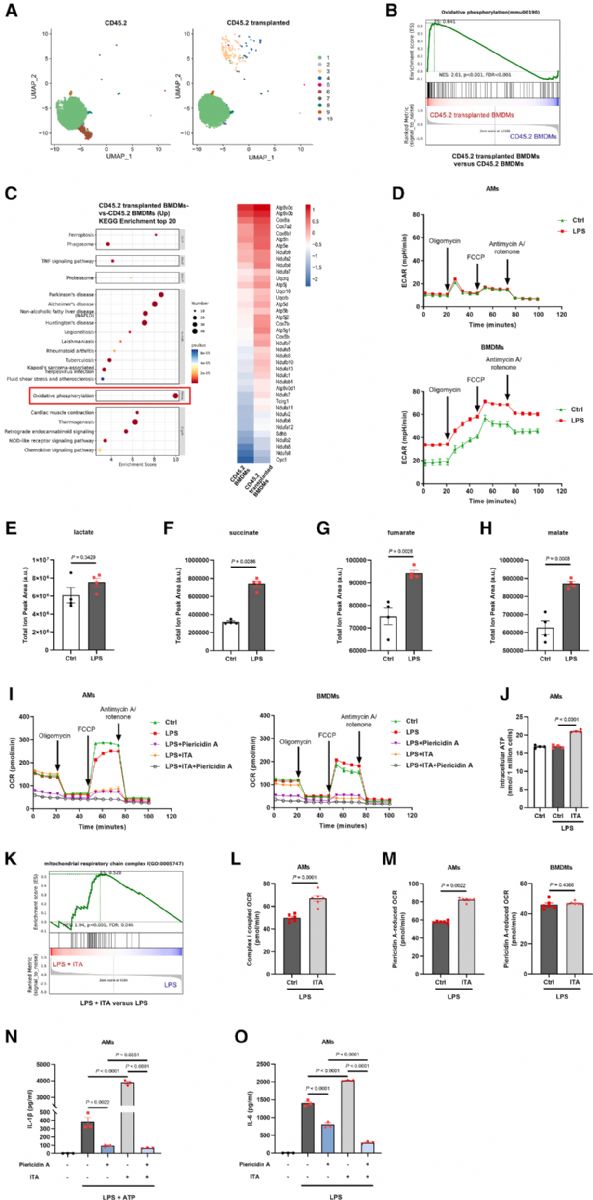
Fig6. 衣康酸通過增強ETC-CI活性促進AMs中的炎癥反應
7 衣康酸加劇LPS誘導的急性肺損傷并促進人源AMs中IL-1β的產生
肺泡巨噬細胞(AMs)是宿主防御系統的重要組成部分,能快速響應病原體或危險信號并啟動炎癥反應,但在病理狀態下也可能加劇組織損傷。前面的研究已證實,衣康酸在體內可增強AMs的促炎反應。作者進一步評估了該效應在體內的病理生理相關性。小鼠在接受衣康酸預處理后,再給予LPS誘導急性肺損傷,結果顯示肺組織損傷加重,灌洗液中IL-1β、IL-6和IL-12水平顯著升高,而TNF-α無明顯變化。分離的AMs也表現出更高的促炎因子表達。
為確認AMs是否為衣康酸促炎作用的關鍵靶細胞,作者分別使用脂質體氯膦酸和Itgax-2A-tdTomato-2A-DTR(NM-KI-204992)小鼠(該品系在全CD11c啟動子調控下表達白喉毒素受體DTR)耗竭AMs,結果均顯示衣康酸的促炎效應被完全阻斷,證實AMs是其主要作用細胞。此外,Irg1-/-小鼠在致死劑量LPS處理后的生存率高于野生型,提示內源性衣康酸加重肺損傷。人源AMs實驗也顯示衣康酸顯著促進IL-1β釋放,表明其促炎作用具有跨物種一致性。
綜上,衣康酸通過作用于AMs增強其促炎功能,加劇LPS誘導的急性肺損傷,這一作用在小鼠和人類中均存在,提示其在臨床應用中需謹慎評估其潛在的促炎風險。
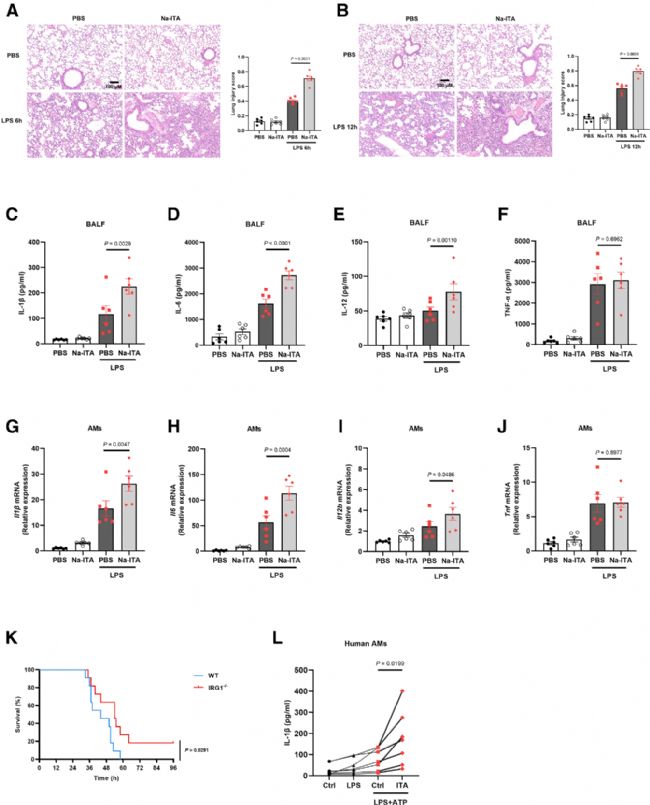
Fig7. 衣康酸加劇LPS誘導的急性肺損傷并促進人源AMs中IL-1β的產生
綜上所述,本研究明確揭示衣康酸在AMs中具有顯著的促炎功能,能夠加劇LPS誘導的急性肺損傷,其效應依賴于AMs的存在,并在小鼠與人類中均表現一致。這一發現顛覆了衣康酸傳統的“抗炎代謝物”認知,提示在其臨床轉化過程中需警惕其在肺部微環境中可能引發的促炎作用。
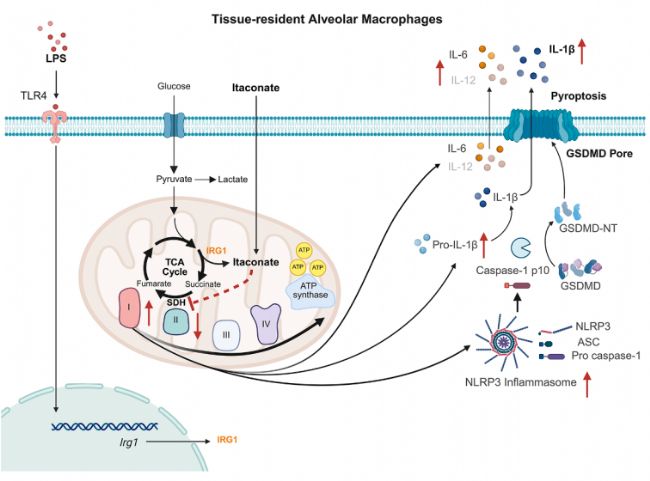
圖8. 衣康酸在AMs中的作用機制
南模生物擁有經驗豐富的模型定制團隊,可為客戶定制敲除、條件性敲除、點突變、人源化、敲入等多種類型的基因編輯小鼠。此外,南模生物擁有含上萬種成品小鼠的模型資源庫,基本覆蓋熱門基因的敲除/條件性敲除小鼠、免疫缺陷小鼠、靶點人源化小鼠、自發疾病小鼠、Cre/Dre 工具鼠、熒光示蹤小鼠等。
若您有相關需求,歡迎撥打400-728-0660熱線,或通過南模生物微信公眾號在線咨詢,或致信marketing@modelorg.com。我們的專業團隊將竭誠為您服務!
Reference:
[1] Ye D, Wang P, Chen LL, Guan KL, Xiong Y. Itaconate in host inflammation and defense. Trends Endocrinol Metab. 2024;35(7):586-606. doi:10.1016/j.tem.2024.02.004
[2] Shan M, Zhang S, Luo Z, et al. Itaconate promotes inflammatory responses in tissue-resident alveolar macrophages and exacerbates acute lung injury. Cell Metab. Published online June 14, 2025. doi:10.1016/j.cmet.2025.05.012
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。