高分文章解讀:鐵死亡在腫瘤,造血干細胞,心血管疾病中的調控機制
8月24日,一年一度的國家自然科學基金又重磅放榜啦。2023年度受理期間,國家自然科學基金委員會共接收項目申請超過30萬項,其中有2萬項通過審批獲得了項目資助。查閱相關的中標項目,我們不難發現一些眼熟的關鍵詞仍然備受青睞:
| 巨噬細胞 | 干細胞 |
| 線粒體 | 甲基化 |
| 炎癥 | 細胞衰老 |
| 自噬 | 細胞焦亡 |
| 鐵死亡 | 腫瘤微環境 |
鐵死亡作為一種新型的細胞死亡機制相信大家已經不陌生,近幾年來鐵死亡的熱度一直居高不下,2023年更是有超過500項標書立項!除了連續稱霸國自然熱度榜以外,鐵死亡也是近幾年高分雜志的寵兒,頻頻摘得熱門雜志的青睞。這么火爆的熱點大家還不追嘛?今天小優就用幾篇近3年的高分文獻帶大家深度了解鐵死亡的研究方向和方法。因為篇幅有限,這次我們先分享其中的5篇文章,剩下的文章分享請繼續關注我們下篇文章。
鐵死亡是一種鐵依賴性的,非細胞凋亡性的細胞死亡形式,主要是細胞內脂質活性氧(ROS)生成與降解的平衡失調所致。對鐵死亡還不了解的小伙伴可以點擊查看我們之前的文章分享:53分鐵死亡相關Review,究竟寫了啥?近幾年鐵死亡的研究已經深入到各個系統和疾病,其中在癌癥研究,腫瘤研究,免疫療法等領域都有著非常熱門的研究。話不多說,接下來我們就一睹為快吧!
1、Ferroptosis surveillance independent of GPX4 and differentially regulated by sex hormones
發表期刊:Cell(IF:64.5)
發表時間:2023年6月
鐵死亡是一個鐵依賴性的磷脂過氧化反應誘導的細胞死亡程序,已知有兩個主要的監察機制來抑制鐵死亡:分別是glutathione peroxidase 4 (GPX4)和其他的介導的酶例如FSP1,DHODH,NOS2和GCH1。除了現存的GPX4和RTAs通路以外是否還有其他的機制?來自紀念斯隆-凱特琳癌癥中心的姜學軍團隊對此問題進行探究,揭示了一種受性激素調控的新監測機制。
在本篇文章中,作者通過全基因組 CRISPR 激活篩選,然后進行機理研究,發現磷脂修飾酶 MBOAT1 和 MBOAT2 是鐵死亡的抑制因子。MBOAT1/2通過重塑細胞磷脂結構來抑制鐵突變,他們的鐵死亡監視功能不依賴于GPX4或FSP1。MBOAT1 和 MBOAT2通過性激素受體(即雌激素受體(ER)和雄激素受體(AR))上調。將ER或AR拮抗劑與鐵死亡誘導相結合,可顯著抑制ER+乳腺癌和AR+前列腺癌。
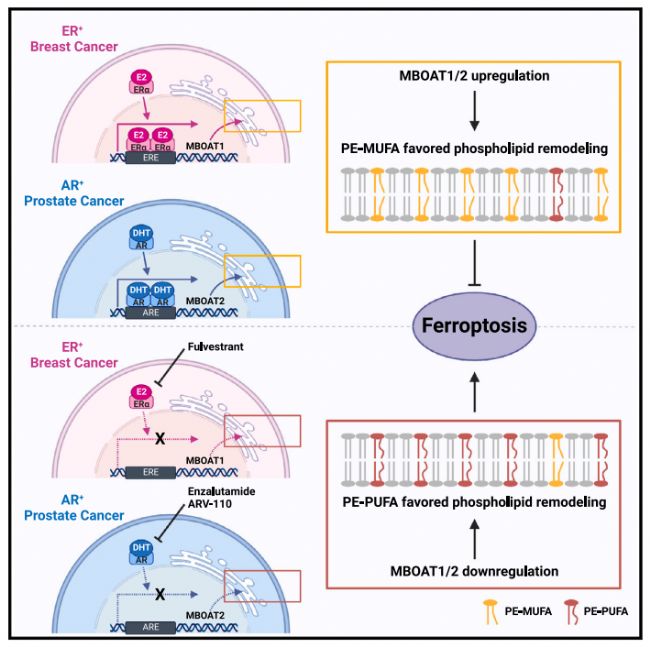
文章的大概思路如下:
1.為了鑒定鐵死亡抑制的基因,作者用GPX4抑制劑RSL3和鐵死亡誘導物(FINs)在人纖維瘤細胞HT1080細胞中構建了全基因CRISPR激活篩選系統,作者發現了一個新的鐵死亡抑制基因MBOAT2。經過驗證,MBOAT2是一個鐵死亡抑制基因,不依賴于GPX4和FSP1。
2.作者接下來驗證MBOAT2抑制鐵死亡是否通過磷脂(PL)的新陳代謝。結果顯示MBOAT2介導的鐵死亡活性抑制依賴于內源性和外源性的單不飽和脂肪酸MUFA。
3.由于MBOAT2抑制鐵死亡是一個MUFA依賴性的行為,接下來作者繼續驗證MBOAT2抑制鐵死亡是否通過PL重塑。結果表明MBOAT2抑制鐵死亡通過磷脂重塑,MBOAT2在對抗內源性的MUFA誘導的鐵死亡中起到重要作用。
4.通過對比多種正常組織和癌癥組織的MBOAT2表達水平,作者發現MBOAT2在前列腺癌癥(PCa)中特異性上調。進一步研究發現,雄激素受體(AR)信號通路調節鐵死亡依賴于MBOAT2。并且AR信號通路促進細胞對鐵死亡的耐受通過上調MBOAT2的表達和重塑細胞PL。
5.因為在AR+ PCa中上調MBOAT2可以促進鐵死亡耐受,作者繼續研究AR拮抗劑是否可以作為一個治療策略通過下調MBOAT2使腫瘤細胞對鐵死亡更敏感。結果表明AR拮抗劑使AR+前列腺癌癥對鐵死亡敏感。
6.作者對MBOAT家族進行進一步研究,發現MBOAT1也可以抑制鐵死亡。AR可以調節MBOAT2而不調節MBOAT1,而ER可以調節MBOAT1而不調節MBOAT2。結果表明,MBOAT1和MBOAT2通過不同途徑調節鐵死亡。
7.作者接下來繼續研究是否ER和AR拮抗劑可以激活ER+ BCa對鐵死亡的敏感性通過下調MBOAT。結果表明將ER或AR拮抗劑與鐵死亡誘導相結合,可顯著抑制ER+乳腺癌和AR+前列腺癌。
綜上所述,這一系統性的研究揭示了一種不依賴于GPX4或FSP1的新的調控機制,性激素信號通過MBOAT1/2介導的PL重塑抑制癌癥細胞鐵死亡,為癌癥治療提供新的思路。
文章中使用到的技術主要有:構建CRISPR敲除小鼠,CRISPR激活檢測和數據分析,RNA測序,ChIP,構建耐藥小鼠模型
2、Human hematopoietic stem cell vulnerability to ferroptosis
發表期刊:Cell(IF:64.5)
發表時間:2023年2月
造血干細胞(HSCs)具有許多獨特的機制來維持血液細胞的生成,來自丹娜法伯癌癥研究所的Vijay G. Sankaran團隊發現人類造血干細胞容易收到鐵死亡的影響,并對其機制做了深入的研究。
作者從一種因組蛋白去泛素化酶 MYSM1缺失導致的骨髓衰竭疾病得到啟發,表明造血干細胞蛋白質合成減少如何導致鐵死亡增加。盡管蛋白質生成速率沒有改變,通過阻斷鐵死亡可以完全挽救造血干細胞的功能。重要的是,這種對鐵死亡選擇性的脆弱不僅是MYSM1缺乏時造血干細胞喪失的基礎,也闡釋了人類造血干細胞廣泛的依賴性。通過過表達MYSM1提高蛋白質合成速率,可降低造血干細胞對鐵死亡的敏感性。
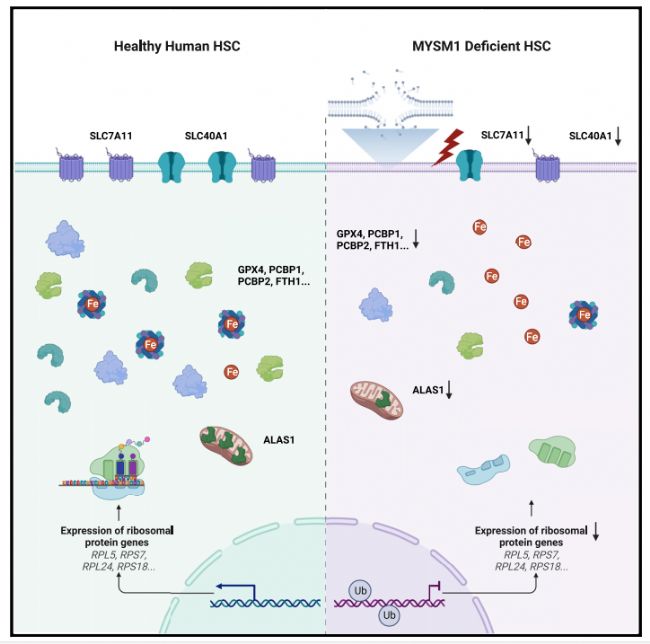
文章的大概思路如下:
1.骨髓衰竭綜合征是由于MYSM1的突變引起的,作者想探究MYSM1和造血干細胞之間是否有關聯。經過實驗表明,MYSM1缺失會損傷人HSC功能。
2.接下來作者驗證MYSM1如何影響HSC的功能。作者通過RNA測序發現和核糖體相關的基因都有明顯下調。在MYSM1缺失的HSC中,核糖體蛋白水平明顯下降。作者又進一步檢測了蛋白生成率,發現MYSM1缺失引起HSCs蛋白生成率下降。
3.接下來作者繼續研究MYSM1如何影響HSC功能。作者發現在MYSM1缺失的HSC中,氧化劑解毒,抗氧化劑,和鐵結合基因明顯上調,有關鐵新陳代謝和抗氧化相關的基因上調,經過進一步研究發現,MYSM1缺失引起HSC功能影響是因為鐵死亡。而抑制鐵死亡可以緩解MYSM1缺失帶來的HSC功能影響。
4、作者接下來進一步研究鐵死亡和HSC功能失調相關的具體機制。作者檢測了鐵死亡相關的基因和通路,結果發現在MYSM1敲除的細胞中保護細胞免受鐵死亡的基因都有明顯的下調。MYSM1缺失造成的轉錄速率下調是通過鐵死亡保護的基因轉錄效率下降而影響HSC功能。
綜上所述:這一系統性的研究揭示了MYSM1缺失通過鐵死亡導致HSC功能影響,此研究為治療藥物耐受的癌癥和棘手的血液疾病提供新的臨床思路。
文章中使用到的技術主要有:構建轉基因小鼠模型,CRISPR/Cas9,RNA測序,流式,電鏡檢測
3、A non-canonical vitamin K cycle is a potent ferroptosis suppressor
發表期刊:Nature(IF:64.8)
發表時間:2022年8月
鐵死亡是一種非凋亡性細胞死亡形式,以鐵依賴性脂質過氧化為特征,在器官損傷、退行性疾病和耐藥性癌癥的易感性中起著關鍵作用。來自德國亥姆霍茲慕尼黑研究中心的 Marcus Conrad 團隊發現了維生素K在介導鐵死亡中新功能,完全還原形式的維生素K可作為一種抗氧化劑,有效抑制細胞鐵死亡。
在文章中作者展示了維生素 K 的完全還原形式——萘醌(包括甲萘醌和植物醌)除了作為γ-谷氨酰羧化酶的輔助因子與血液凝固有關的常規功能外,還具有很強的抗鐵死亡功能。研究發現,鐵死亡抑制蛋白1(FSP1)是一種 NAD(P)H-泛醌還原酶,它能有效地將維生素 K 還原成氫醌,而氫醌是一種強效的自由基捕獲抗氧化劑和(磷)脂質過氧化抑制劑。另外,FSP1 介導的維生素 K 還原對warfarin中毒也有解毒作用。由此可見,FSP1 是介導warfarin耐受的維生素 K 還原的酶。 FSP1 依賴的非經典維生素 K 循環可保護細胞免受有害的脂質過氧化和鐵死亡。
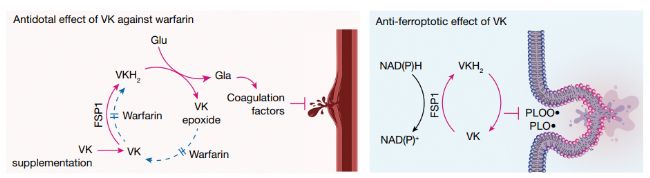
文章的大概思路如下:
1.為了探究是否還有其他機制能有效抑制鐵死亡,作者在他莫昔芬(TAM)誘導Gpx4缺失的小鼠胚胎成纖維細胞(簡稱Pfa1細胞)中系統地研究了多種天然維生素化合物。除了α-生育酚(α-TOH)這種生物活性最強的維生素E外,作者發現有三種形式的維生素K——即植物醌、甲萘醌-4(MK4)和甲萘醌,能使細胞免遭Gpx4缺失誘導的鐵死亡。進一步研究發現,這三種形式的維生素K都能有效抑制脂質過氧化。
2.接下來作者繼續檢測維生素K是否也能在體內抑制鐵死亡。作者將TAM誘導的肝細胞特異性Gpx4缺失小鼠中,在維生素E缺乏的條件下,超營養水平的甲萘醌-4(MK4)延長了小鼠的存活時間,并有力保護了其肝臟。在小鼠肝臟和腎缺血再灌注損傷模型中,用MK4進行預處理都可改善器官損傷,減少脂質過氧化反應,降低細胞死亡。
3.維生素K可以轉化成為氫醌 (VKH2),而氫醌是一種有效的自由基捕獲抗氧化劑(RTA),可以抑制脂質過氧化。作者繼續研究FSP1是否可以充當維生素K還原劑并產生VKH2以一直脂質過氧化,結果表明,FSP1可以介導維生素K還原,并維持VKH2作為RTA的功能。
4.作者進一步研究維生素K抑制鐵死亡的機制,通過實驗發現FSP1對維生素K的還原作用是葉綠醌和MK4抗鐵死亡作用的原因。維生素K通過FSP1阻止鐵死亡。
5.在血栓形成等疾病的治療中通常warfarin作為抗凝劑,而warfarin也常常會帶來無法凝血的副作用。使用高劑量維生素K是warfarin中毒的有效的解毒劑,由于FSP1可以還原維生素K,作者繼續探究FSP1的酶活性是否可以介導warfarin耐受的維生素K還原途徑。結果表明,FSP1是warfarin耐受的維生素 K 還原酶,可以防止warfarin毒性。
綜上所述,這一系列研究表明維生素K可以通過其完全還原形式VKH2發揮抗鐵死亡的作用,而FSP1是維生素還原酶,介導了維生素K抗鐵死亡作用,和維生素K抗warfarin中度的作用,為維生素K在鐵死亡及血栓形成相關疾病的治療以及改善warfarin治療中產生的副作用提供新的思路。
文章中使用到的技術主要有:細胞毒性分析,免疫組化,質譜分析,細胞凋亡,細胞遷移和侵襲
4、Cysteine depletion induces pancreatic tumor ferroptosis in mice
發表期刊:Science(IF:56.9)
發表時間:2020年4月
胰腺導管腺癌(PDAC)是一個致命的癌癥并且對多種治療效果耐受,超過90%的PDAC細胞會通過KRAS突變來促進自身的繁殖,這樣的突變會增加脂質活性氧(ROS)的產生并且損傷細胞功能。為了自救,PDAC細胞通常會通過提高半胱氨酸衍生的代謝物如谷胱甘肽(GSH)來解除ROS毒性,避免自身死亡。來自哥倫比亞大學醫療中心的Kenneth P. Olive團隊為我們揭示了半胱氨酸缺失可以誘導胰腺腫瘤鐵死亡,抑制胰腺癌生長。
鐵死亡是由ROS的災難性積累導致,而半胱氨酸衍生的代謝物會抵消ROS的積累。作者發現,PDAC通過Glu/胱氨酸轉運體(xC系統)輸入氧化半胱氨酸(胱氨酸),同時利用半胱氨酸合成谷胱甘肽(glutathione)和輔酶A(coenzyme A)來抑制自身的鐵死亡。缺失xC系統亞基Slc7a11或者通過胱氨酸酶類的藥物都能夠誘導PDAC細胞的鐵死亡并抑制腫瘤生長。
文章的大概思路如下:
1.為了研究PDAC中的半胱氨酸代謝,作者在PDAC細胞中添加胱氨酸、xC系統的抑制劑(IKE)并測定細胞活力。實驗結果發現半胱氨酸可增加細胞活力,xC系統的抑制劑使細胞存活率下降,同時鐵死亡相關的抑制劑可減緩半胱氨酸耗竭而引起的細胞活力下降。并且半胱氨酸耗竭后細胞死亡前脂質氧化(鐵死亡的一個標志)的大量增加,鐵死亡相關的抑制劑同樣也可以抵消,表明PDAC細胞中半胱氨酸耗竭將引發鐵死亡。
2.作者用小鼠腫瘤模型進行進一步驗證。結果表明在胰腺癌模型KPFSR小鼠中,xC系統的主要亞基Slc7a11基因敲除后腫瘤的生長減緩、小鼠的中位生存期增加了一倍。添加NAC(半胱氨酸類似物),小鼠的中位生存期又減少,并且腫瘤負荷增加。同時,Slc7a11的缺失,誘導了細胞的鐵死亡,出現脂滴樣球狀上皮細胞和線粒體病變(鐵死亡的標志)以及鐵死亡相關基因的表達增加。
3.之前的研究表明,半胱氨酸主要通過GSH的合成來抑制細胞鐵死亡,=然而單獨BSO(GSH抑制劑)不能誘導PDAC細胞脂質氧化或降低細胞活力,這表明可能有其他半胱氨酸衍生代謝物有助于調控鐵死亡。作者通過質譜檢測標記的外源胱氨酸代謝物,發現胱氨酸在24小時內轉化為輔酶A(CoA),而IKE可明顯抑制CoA 水平,外源性CoA可以抑制IKE誘導的PDAC細胞鐵死亡)。綜上,聯合抑制GSH和輔酶A(CoA)可誘導PDAC細胞鐵死亡。
4.作者在細胞模型及腫瘤模型上驗證半胱氨酸酶的作用。半胱氨酸酶誘導PDAC細胞系脂質氧化,降低細胞活力;其次,半胱氨酸酶治療的小鼠的腫瘤組織明顯出現鐵死亡表型(脂滴形成、間質破壞),并且腫瘤體積相比對照組明顯減小。
綜上所述,作者通過一些列的研究表明某些癌癥,例如PDAC依賴于半胱氨酸代謝抑制鐵死亡,半胱氨酸缺失對于腫瘤生長有抑制作用,為半胱氨酸酶用于腫瘤治療提供了新的研究思路。
文章中使用到的技術主要有:細胞毒性實驗,流式細胞術,基因編輯,動物模型,液相色譜
5、Exosomes secreted from cardiomyocytes suppress the sensitivity of tumor ferroptosis in ischemic heart failure
發表期刊:Signal Transduction and Targeted Therapy(IF:39.3)
發表時間:2023年3月27日
心血管疾病和癌癥一直以來都是嚴重危及生命的兩大疾病,并且心力衰竭(HF)患者通常有較高的患癌風險。由于鐵死亡在治療耐藥性癌癥和其他退行性疾病方面發揮著重要作用,因此靶向鐵死亡被認為是癌癥治療的新途徑。外泌體對近端和遠端器官通訊至關重要,并通過旁分泌方式調節疾病的發生。然而,外泌體是否能影響癌癥對鐵死亡的敏感性尚不清楚。來自哈爾濱醫科大學的楊寶峰團隊首次揭示了心肌梗死(MI)可以通過釋放心肌細胞的miR-22-3p富集外泌體顯著抑制ACSL4蛋白的表達,從而降低腫瘤細胞對鐵死亡的敏感性。
心肌梗塞(MI)會降低癌細胞對鐵死亡激活劑 erastin或 imidazole ketone erastin的敏感性。MI后血漿外泌體有效地減弱了腫瘤細胞對鐵死亡誘導劑的敏感性。在慢性心肌梗死小鼠和高血壓患者的衰竭心臟中,miR-22-3p 在心肌細胞和血漿外泌體中的表達明顯上調。用從心肌梗死后小鼠血漿中分離出的外泌體培養腫瘤細胞或單獨過表達miR-22-3p可減輕erastin誘導的鐵死亡。心肌細胞的miR-22-3p會被外泌體包裝并轉移到腫瘤細胞中。用 AAV9 sponge抑制心肌細胞特異性 miR-22-3p增加了癌細胞對鐵死亡的敏感性。促鐵死亡基因 ACSL4 是 miR-22-3p在腫瘤細胞中的靶點。
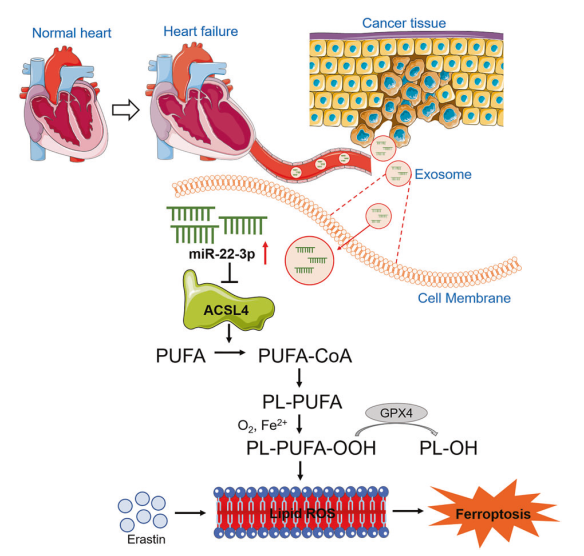
文章的大概思路如下:
1.為了闡明心肌梗死后(post-MI)的心力衰竭(HF)對癌細胞鐵死亡敏感性的影響,作者使用鐵死亡誘導劑erastin和IKE,在sham或MI實驗模型中抑制移植瘤的生長。結果表明,MI在很大程度上抑制了erastin或IKE誘導的小鼠腫瘤生長的減少。MI誘導的HF在體內抑制了腫瘤對鐵死亡的敏感性。
2.作者繼續研究MI影響癌細胞對鐵死亡敏感性的具體機制。研究表明,外泌體會影響癌癥的進程,作者決定研究HF中的外泌體是否會影響erastin誘導的鐵死亡,結果表明,erastin在LLC移植瘤模型中會誘導脂質過氧化并抑制腫瘤生長,而用MI后的外泌體(MI-EXO)處理可顯著恢復。MI外泌體也可以逆轉erastin引起的Ki67降低和4-HNE增加。結果表明,來自MI誘導的HF的外泌體可以降低腫瘤對鐵死亡的敏感性。
3.作者繼續在體外用細胞系進行驗證。作者分離了Sham-EXOS和MI-EXOS并與小鼠LLC肺癌細胞系或K7M2骨肉瘤細胞系共培養,結果表明,erastin明顯增加了脂質ROS積累,而MI-EXO減輕了這一作用和erastin誘導的鐵死亡,MI-EXO處理的細胞內鐵離子水平普遍下降。此外,MI-EXO抑制鐵死亡,促進癌細胞增殖、侵襲和遷移。以上結果表明外泌體可抑制癌癥細胞鐵死亡。
4.為了更好地了解外泌體的病理機制,作者分析了缺血心肌中miRNA的含量,發現miR-22-3p含量最豐富,此外,小鼠缺血心肌和血漿外泌體中的miR-22-3p水平均上調。這些結果表明,MI-EXO的miR-22-3p減弱了癌細胞對erastin誘導的鐵死亡的敏感性。
5.為了證實功能性血漿外泌體主要來源于MI誘導的衰竭心肌細胞,作者從Sham-Myo和MI-Myo小鼠的成年心室肌細胞中獲取并純化了心肌外泌體Myo-EXOSham和Myo-EXOMI,發現MI-EXO/Myo-EXOMI的促癌作用確實是通過miR-22-3p介導的,并且內源性miR-223p也抑制了腫瘤細胞的鐵死亡。
6.接下來,作者對MiR-22-3p相關的靶基因進行驗證,作者篩選出了MiR-22-3p作用的靶基因acyl-CoA synthetase long-chain family member 4(ACSL4)以及結合位點,并通過實驗驗證了miR-22-3p通過靶向ACSL4抑制erastin誘導的腫瘤細胞鐵死亡。
綜上所述,MI-EXO在降低癌癥細胞對鐵死亡的敏感性中起到了重要的作用并且會促進腫瘤的生長,外泌體的miR-22-3p下調ACSL44是抑制癌癥細胞對鐵死亡敏感性的分子機制,這一系列研究也為靶向外泌體介導的心肌細胞/腫瘤病理通訊基于鐵死亡的抗腫瘤治療提供了新的思路。
文章中使用到的技術主要有:超聲心動圖系統,移植瘤模型,外泌體分離,納米粒子跟蹤分析(NTA),透射電子顯微鏡,遷移和侵襲試驗