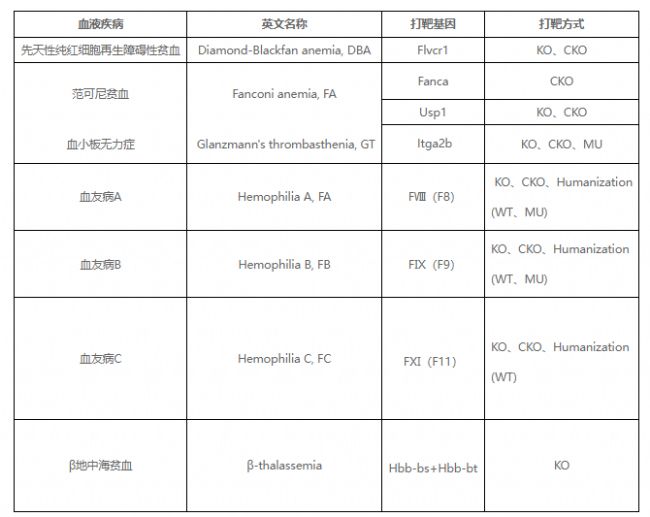
由FⅧ(F8)、FⅨ(F9)基因突變引起的血友病基因治療方法
上一期我們提到了關于眼科熱門靶點RHO是如何實現「1+1=1」式基因治療的,本期一起來關注血液罕見病——由FⅧ(F8)、FⅨ(F9)基因突變引起的血友病。該疾病患者終身伴有自發性或外傷后長時間出血不止的傾向,連日常的輕微碰撞都有可能引發出血而危及生命,因此也被稱之為“玻璃人”。如何攻克血友病、拓展其研究深度是許多人關心的問題。
FⅧ、FⅨ的致病機理
血友病A(FA)和血友病B(FB)是由于FⅧ和FⅨ基因的突變而引起的血液凝固紊亂的X染色體隱性遺傳病,正因為是X染色體隱性疾病,只有當父母雙方都攜帶致病基因時,女孩XX才會發病,而男孩XY因為只有一條X染色體,只要父母雙方一方攜帶致病基因,男孩就有可能致病,故臨床上血友病常為男孩發病。
FⅧ和FⅨ凝血因子是人體血液凝固過程中不可或缺的成分,當這些基因受到突變時,人體無法產生足夠的凝血因子,從而導致患者在受傷或手術后無法正常止血。
FⅧ基因已報道的突變多達3000種以上,其中錯義突變和無義突變約占57.4%,主要在肝臟中表達,遺傳異質性高,無突變熱點,但F8基因內含子22倒位是重型血友病A主要原因,即FⅧ基因在內含子22處發生斷裂和倒位,使FⅧ基因外顯子1-22與外顯子23-26分離,無法進行正常轉錄,造成FⅧ因子嚴重缺乏,導致重型血友病A的發生[1]。
FⅨ基因突變數據庫中已報道3000多種相關突變,其中點突變(60.8%)占了最大的比例,大片段缺失約占其中的7.5%,無突變熱點報道。
FA和FB的基因治療
血友病A(約1/5000)較血友病B發病率高(約1/25000),長期以來血友病A被認為是基因治療的理想靶點,因為1%-5%的正常血漿FⅧ可以顯著改善患者的生活質量,比如最常見的酶替代療法管線,Spark公司的Spk-9001,把FⅨ變體Padua特異表達在肝臟細胞內來改善凝血功能,達到治本效果。
為了能從根本上治療血友病,Intellia公司通過CRISPR/Cas9在非人靈長類動物的肝臟中靶向插入FⅨ基因,可產生正常水平或更高水平FⅨ,目前正在IND申請階段[2];同時文獻中也有許多CRISPR療法[3-4]。可以看出CRISPR療法在治療血友病中有著光明的前景,這也對小鼠模型的基因人源化程度提出了更高的要求。特別是FⅧ和FⅨ基因的致病突變多且異質性強,而文獻中現有研究以KO小鼠為主,無法滿足基因療法對臨床前動物模型的要求。
想了解更多人源化小鼠的構建技術以及在基因治療中的應用?

「碼」上下載《人源化小鼠模型的構建和應用》PDF
應運而生的血友病全人源化模型
針對當前的研究困境,賽業生物啟動了「下一代全基因組人源化模型構建計劃」HUGO-GTTM(HUGO-GT: Humanized Genomic Ortholog for Gene Therapy),成功構建了血友病相關的全基因組人源化模型:hFⅧ和hFⅨ小鼠,在X染色體上用人FⅧ或人FⅨ基因(全基因組)原位替換鼠源基因,可以實現動物模型與人類疾病致病機理同源性一致。
X染色體基因突變導致的疾病除了血友病,還有MeCP2基因突變導致的雷特綜合征、DMD基因導致的杜氏肌營養不良癥等,賽業生物可以提供hFⅧ、hFⅨ、FⅪ、hMeCP2、hDMD等HUGO-GTTM全基因組人源化小鼠,并在該基礎上構建熱門點突變疾病模型,更適用于遺傳性疾病研究和基因治療藥物開發。