人類癌癥中TERT轉錄激活及端粒酶活性激的機制:老演員與新角色
文獻來源:Yuan, XT.,Xu, DW. et al.Mechanisms underlying the activation of TERT transcription and telomerase activity in human cancer: old actors and new players https://doi.org/10.1038/s41388-019-0872-9

研究背景
端粒酶是一個多亞基復合物,但其核心酶僅由催化組分TERT(端粒酶逆轉錄酶)和內部端粒酶RNA模板(TERC)組成。TERC在多種人類細胞中普遍表達,而TERT基因在大多數人類體細胞中受到嚴格抑制,從而導致端粒酶失活。因此,TERT是控制端粒酶活性的關鍵限速因素。
研究概述
摘 要
本文綜述了人類癌癥中TERT基因轉錄和端粒酶活性的激活機制,重點探討了傳統調控因子(如轉錄因子、表觀遺傳修飾)和新興基因組變異(如啟動子突變、結構重排)的作用,并分析了其在癌癥精準醫療中的潛在應用。
研究方法
<數據庫>PubMed。
研究結果
TERT與端粒酶在癌癥中的核心作用
1.癌癥保護機制與TERT抑制
人類通過抑制端粒酶活性(主要依賴TERT基因的轉錄抑制)和維持較短端粒延緩癌癥發生,從而限制細胞無限增殖能力。TERT的沉默導致端粒縮短,最終觸發復制性衰老(senescence),作為天然的抗癌屏障。
2.TERT激活與癌癥發生
端粒依賴性功能:TERT激活通過穩定端粒長度,繞過衰老屏障,促進細胞永生化。非端粒依賴性功能:TERT通過調控線粒體功能、DNA損傷修復、Wnt/β-catenin信號通路、EMT、血管生成等途徑,增強癌癥干性、侵襲和轉移能力。
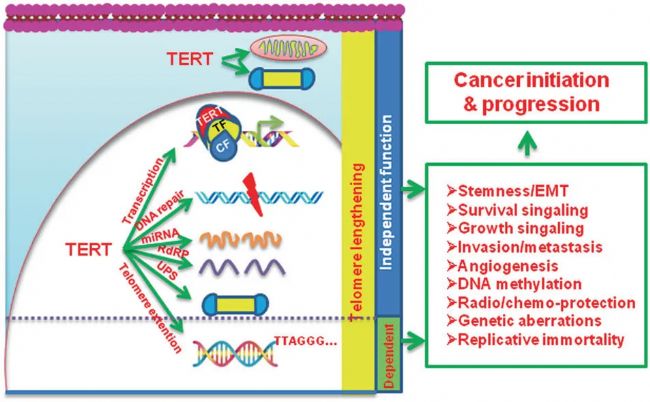
圖1 TERT在癌癥發生發展中的多重致癌作用
TERT/端粒酶激活通過穩定端粒長度(端粒延長依賴性)是人類細胞轉化和無限增殖所必需的。TERT不依賴端粒延長的功能顯著促進癌癥發生/進展,TERT對UPS的作用主要發生在細胞核內,但也可能在細胞質中發生。
TERT激活的核心機制
1.轉錄調控與表觀遺傳修飾
MYC、Sp1、ETS家族(如GABPA/B1)等通過結合TERT啟動子區域激活轉錄;而Mad1、TGF-β/Smad等起抑制作用。TERT啟動子高甲基化(如THOR區域)與癌癥中TERT表達相關。
2.基因組變異
熱點突變:C228T和C250T(5p15.33)創建ETS結合位點,招募GABPA/B1復合物驅動TERT轉錄。
其他突變:MYC結合位點突變(如腎透明細胞癌)可能解除抑制性復合物(MAX/Mad1)的結合。
結構重排與增強子劫持:TERT基因與遠端超級增強子(super-enhancer)或病毒增強子(如HBV、AAV2)的異常連接,導致染色質重塑和轉錄激活。
基因擴增:TERT拷貝數增加(如神經母細胞瘤、卵巢癌)直接提升表達水平。
3.病毒介導的調控
HPV E6、HBV等病毒蛋白通過結合TERT啟動子或插入病毒增強子(如HBV整合)激活TERT轉錄。
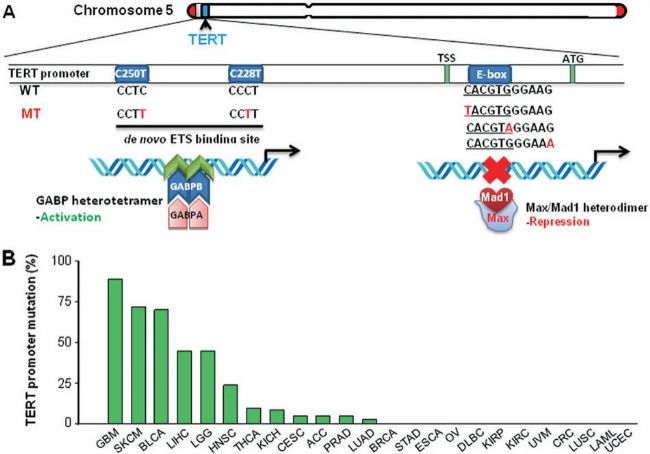
圖2 人類癌癥中的TERT啟動子突變
A TERT啟動子突變及相關轉錄因子示意圖:顯示了位于5號染色體短臂的TERT基因及其啟動子。
B 基于TCGA數據集分析的各類癌癥TERT啟動子突變頻率。
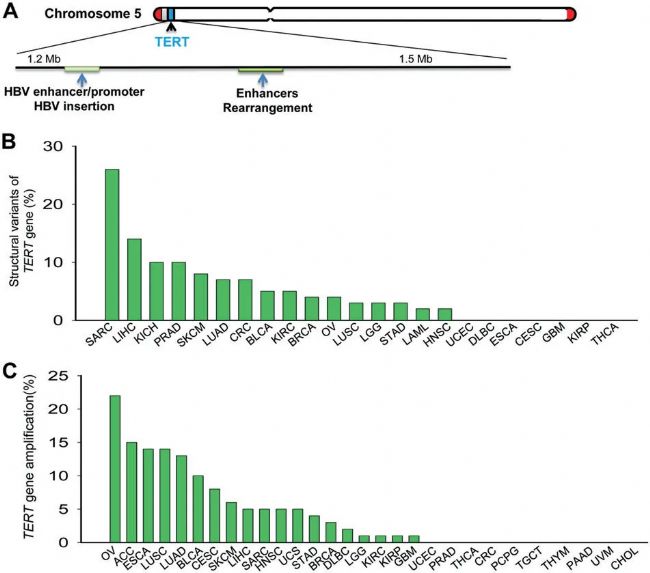
圖3人類癌癥TERT基因的結構改變和擴增
A TERT基因座的重排和病毒,B和C 分別展示TCGA隊列分析中多種人類惡性腫瘤的TERT基因結構變異和擴增情況。
臨床意義與應用
1.診斷與預后標志物
TERT啟動子突變:在膠質母細胞瘤(80-90%)、黑色素瘤、膀胱癌等高發,可通過液體活檢(血漿、尿液、腦脊液)實現無創檢測。
甲基化標志物:TERT啟動子高甲基化(如胃腸道癌)在糞便樣本中具有診斷潛力。
預后關聯:TERT高表達或突變與甲狀腺癌、神經母細胞瘤等侵襲性表型和不良預后相關。
2.治療挑戰與展望
靶向GABPA/B1:在膠質母細胞瘤中抑制GABPB1可降低TERT表達,但在甲狀腺癌中可能促進侵襲(因DICER1抑制)。
表觀遺傳干預:靶向DNA甲基化或組蛋白修飾可能逆轉TERT激活。
端粒酶抑制劑:如Imetelstat,但需平衡正常干細胞(依賴端粒酶)與癌細胞的毒性。
本文提示
大量臨床研究已評估端粒酶/TERT相關改變作為癌癥患者的預后因素。多項研究發現,在多種癌癥類型中,腫瘤組織TERT高表達預示患者不良預后。這些新發現不僅深化了對癌癥特異性TERT轉錄機制的認知,也為臨床癌癥管理提供了實用工具。然而關鍵挑戰在于如何將這些成果轉化為基于端粒酶的治療策略。研究者未來需要更多研究來合理開發基于TERT的癌癥治療策略。
上海翼和RT-PCR法是檢測端粒酶活性檢測的經典技術,用時短,操作簡單,結果準確。

研究背景
端粒酶是一個多亞基復合物,但其核心酶僅由催化組分TERT(端粒酶逆轉錄酶)和內部端粒酶RNA模板(TERC)組成。TERC在多種人類細胞中普遍表達,而TERT基因在大多數人類體細胞中受到嚴格抑制,從而導致端粒酶失活。因此,TERT是控制端粒酶活性的關鍵限速因素。
研究概述
摘 要
本文綜述了人類癌癥中TERT基因轉錄和端粒酶活性的激活機制,重點探討了傳統調控因子(如轉錄因子、表觀遺傳修飾)和新興基因組變異(如啟動子突變、結構重排)的作用,并分析了其在癌癥精準醫療中的潛在應用。
研究方法
<數據庫>PubMed。
研究結果
TERT與端粒酶在癌癥中的核心作用
1.癌癥保護機制與TERT抑制
人類通過抑制端粒酶活性(主要依賴TERT基因的轉錄抑制)和維持較短端粒延緩癌癥發生,從而限制細胞無限增殖能力。TERT的沉默導致端粒縮短,最終觸發復制性衰老(senescence),作為天然的抗癌屏障。
2.TERT激活與癌癥發生
端粒依賴性功能:TERT激活通過穩定端粒長度,繞過衰老屏障,促進細胞永生化。非端粒依賴性功能:TERT通過調控線粒體功能、DNA損傷修復、Wnt/β-catenin信號通路、EMT、血管生成等途徑,增強癌癥干性、侵襲和轉移能力。

圖1 TERT在癌癥發生發展中的多重致癌作用
TERT/端粒酶激活通過穩定端粒長度(端粒延長依賴性)是人類細胞轉化和無限增殖所必需的。TERT不依賴端粒延長的功能顯著促進癌癥發生/進展,TERT對UPS的作用主要發生在細胞核內,但也可能在細胞質中發生。
TERT激活的核心機制
1.轉錄調控與表觀遺傳修飾
MYC、Sp1、ETS家族(如GABPA/B1)等通過結合TERT啟動子區域激活轉錄;而Mad1、TGF-β/Smad等起抑制作用。TERT啟動子高甲基化(如THOR區域)與癌癥中TERT表達相關。
2.基因組變異
熱點突變:C228T和C250T(5p15.33)創建ETS結合位點,招募GABPA/B1復合物驅動TERT轉錄。
其他突變:MYC結合位點突變(如腎透明細胞癌)可能解除抑制性復合物(MAX/Mad1)的結合。
結構重排與增強子劫持:TERT基因與遠端超級增強子(super-enhancer)或病毒增強子(如HBV、AAV2)的異常連接,導致染色質重塑和轉錄激活。
基因擴增:TERT拷貝數增加(如神經母細胞瘤、卵巢癌)直接提升表達水平。
3.病毒介導的調控
HPV E6、HBV等病毒蛋白通過結合TERT啟動子或插入病毒增強子(如HBV整合)激活TERT轉錄。

圖2 人類癌癥中的TERT啟動子突變
A TERT啟動子突變及相關轉錄因子示意圖:顯示了位于5號染色體短臂的TERT基因及其啟動子。
B 基于TCGA數據集分析的各類癌癥TERT啟動子突變頻率。

圖3人類癌癥TERT基因的結構改變和擴增
A TERT基因座的重排和病毒,B和C 分別展示TCGA隊列分析中多種人類惡性腫瘤的TERT基因結構變異和擴增情況。
臨床意義與應用
1.診斷與預后標志物
TERT啟動子突變:在膠質母細胞瘤(80-90%)、黑色素瘤、膀胱癌等高發,可通過液體活檢(血漿、尿液、腦脊液)實現無創檢測。
甲基化標志物:TERT啟動子高甲基化(如胃腸道癌)在糞便樣本中具有診斷潛力。
預后關聯:TERT高表達或突變與甲狀腺癌、神經母細胞瘤等侵襲性表型和不良預后相關。
2.治療挑戰與展望
靶向GABPA/B1:在膠質母細胞瘤中抑制GABPB1可降低TERT表達,但在甲狀腺癌中可能促進侵襲(因DICER1抑制)。
表觀遺傳干預:靶向DNA甲基化或組蛋白修飾可能逆轉TERT激活。
端粒酶抑制劑:如Imetelstat,但需平衡正常干細胞(依賴端粒酶)與癌細胞的毒性。
本文提示
大量臨床研究已評估端粒酶/TERT相關改變作為癌癥患者的預后因素。多項研究發現,在多種癌癥類型中,腫瘤組織TERT高表達預示患者不良預后。這些新發現不僅深化了對癌癥特異性TERT轉錄機制的認知,也為臨床癌癥管理提供了實用工具。然而關鍵挑戰在于如何將這些成果轉化為基于端粒酶的治療策略。研究者未來需要更多研究來合理開發基于TERT的癌癥治療策略。
上海翼和RT-PCR法是檢測端粒酶活性檢測的經典技術,用時短,操作簡單,結果準確。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com