氯喹Chloroquine的作用機理及在自噬、腫瘤、病毒等免疫研究中的應用
Chloroquine(氯喹,CQ,AbMole,M9559)是一種具有多種生物活性的小分子,早期研究聚焦于其對瘧原蟲生命周期的干預作用,后續研究逐漸揭示了Chloroquine在細胞生理、免疫調控及病毒-宿主相互作用中的多靶點效應。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、Chloroquine(氯喹,CQ)的作用機理
1. Chloroquine(氯喹,CQ)對胞內體/溶酶體的酸性環境的抑制
胞內體主要參與細胞內吞物質的運輸,它通過V-ATP 酶主動泵入質子(H+)維持酸性環境(早期胞內體 pH≈6.0,晚期≈5.0)。溶酶體則是一種含多種酸性水解酶(如蛋白酶、核酸酶等)的細胞器,它依賴強酸性環境(pH≈4.5–5.0)發揮降解功能(如降解病原體、衰老細胞器)。Chloroquine(氯喹,AbMole,M9559)巧妙的分子結構使得它在胞外環境中呈脂溶性狀態,可自由穿過細胞膜進入細胞。一旦Chloroquine進入胞內體或者溶酶體中,酸性環境中會使其質子化(形成陽離子),此時無法跨膜擴散進入細胞質中,導致在上述酸性細胞器內的被動積累。Chloroquine(氯喹)的積累會不斷地結合質子(H+),抑制胞內體/溶酶體的酸性環境。
2.Chloroquine(氯喹,CQ)抑制自噬
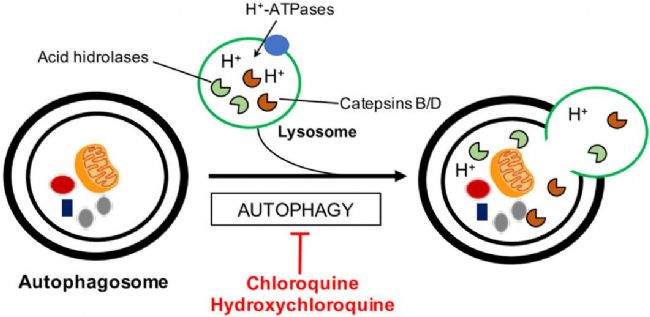
Chloroquine(氯喹,AbMole,M9559)還是一種經典的自噬抑制劑,在自噬的晚期階段,自噬小體與溶酶體形成自噬體,以實現受損細胞器、蛋白、核酸等生物大分子的降解。如前所述,Chloroquine可以抑制溶酶體的pH,進而抑制自噬體的降解能力。另外一方面,Chloroquine還能插入脂質雙層,改變膜流動性,進而影響自噬小體和溶酶體的融合(圖1)。

圖 1. Chloroquine and hydroxychloroquine in autophagy-related mechanisms[1]
二、Chloroquine(氯喹,CQ)的研究應用
1.Chloroquine(氯喹,CQ)用于自噬研究
作為一款經典的晚期自噬抑制劑,Chloroquine(氯喹,AbMole,M9559)可使 LC3-II(自噬標志物)無法被溶酶體降解,表現為細胞內 LC3-II 蛋白水平升高。通過Chloroquine抑制自噬降解,可以觀察其對細胞存活、凋亡、代謝等的影響,判斷某一表型或者細胞行為是否依賴細胞自噬。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
2.Chloroquine(氯喹,CQ)用于腫瘤研究
Chloroquine被發現能夠抑制腫瘤細胞的增殖,Chloroquine(氯喹,AbMole,M9559)可誘導野生型膠質瘤細胞caspase-3 的激活和細胞凋亡的啟動。相較于單一使用,Chloroquine更多被用于和其它抑制劑的聯用,以增加腫瘤細胞對相關抑制劑的敏感性,產生“1+1>2”的效果。例如,在急性髓系白血病(AML)細胞系MV-4-11和THP-1的研究中,Chloroquine與阿糖胞苷(Cytarabine,Ara-C)、柔紅霉素(daunorubicin)和伊達比星(idarubicin)聯合使用,顯著增強了這些抑制劑的抗腫瘤效果,Chloroquine發揮上述功能的機理主要是通過抑制自噬,降低了細胞的“解毒”能力。
3.Chloroquine(氯喹,CQ)用于病毒研究
Chloroquine(氯喹,AbMole,M9559)在體外實驗中顯示出對多種病毒的抑制作用,包括HIV、SARS-CoV、MERS-CoV和Ebola virus[2]。Chloroquine能夠改變細胞內pH值,從而干擾病毒的復制過程。此外,它還可能通過抑制病毒進入宿主細胞、阻斷病毒與宿主細胞受體的結合以及抑制病毒的組裝和釋放來發揮作用[3]。
4.Chloroquine(氯喹,CQ)及羥氯喹(Hydroxychloroquine)用于自身免疫疾病研究
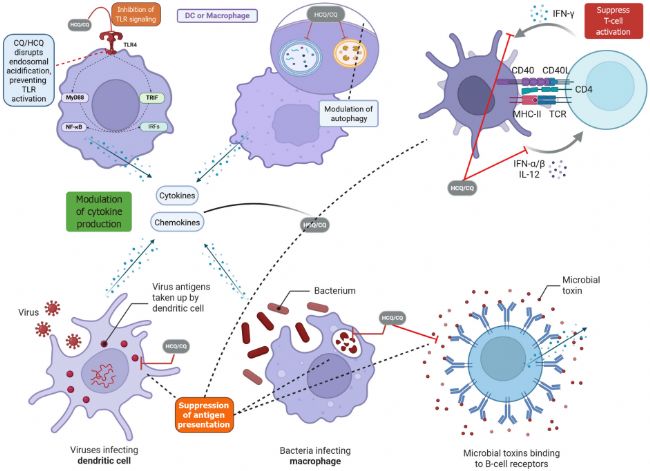
近些年,Chloroquine(氯喹,AbMole,M9559)也是自身免疫性疾病研究領域的明星分子。Chloroquine及其衍生物羥氯喹(Hydroxychloroquine,M11408)被廣泛用于研究系統性紅斑狼瘡(SLE)和類風濕性關節炎(RA)等自身免疫性疾病。Chloroquine的機制包括抑制抗原呈遞細胞的功能,減少炎癥細胞因子的產生,以及調節T細胞和B細胞的活化。這些作用有助于減輕自身免疫性疾病的炎癥反應[4]。

圖 2.Chloroquine抑制自身免疫疾病的原理[4]
三、范例詳解
1.Autophagy. 2024 Oct;20(10):2255-2274
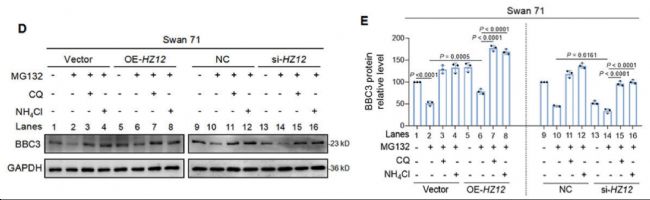
四川大學、中山大學附屬第八醫院的科研人員在上述文章中,發現了一種新的lncRNA,即lnc-HZ12,它在早期胚胎丟失組中存在異常高表達的現象。Lnc-HZ12 抑制 BBC3 伴侶介導的自噬 (CMA) 降解,促進滋養層細胞凋亡。在探究lnc-HZ12對BBC 3的調控機制實驗中,研究人員使用來自AbMole的MG132(AbMole,M1902)、Chloroquine(CQ,AbMole,M9559)、Ammonium chloride(AbMole,M9929)處理lnc-HZ12過表達或沉默的Swan 71細胞,最終成功證明了lnc-HZ12通過自噬-溶酶體途徑降解BBC3蛋白。

圖 3. Lnc-HZ12 suppressed CMA degradation of BBC3[5].
2.Adv Sci (Weinh). 2021 Jan 6;8(4):2003205.
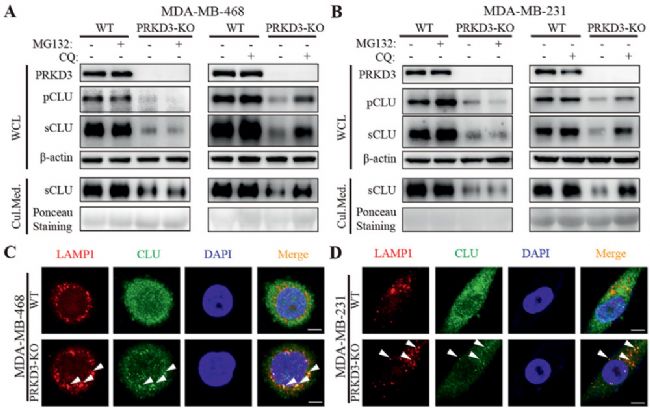
中國科學院蘇州生物醫學工程技術研究所、南京師范大學的實驗人員在上述論文中探索了 PRKD3(Protein Kinase D3)在 TNBC(三陰性乳腺癌)中對 CLU(一種應激激活的分子伴侶)的調控作用及其在腫瘤生長中的作用機制。在實驗中,科研人員使用了AbMole提供的蛋白酶體抑制劑 MG132(AbMole,M1902)和溶酶體抑制劑 Chloroquine(CQ,AbMole,M9559)處理 TNBC 細胞,發現 CQ 能夠顯著恢復 PRKD3 缺失導致的 CLU 降解,而 MG132 無此效果,表明 PRKD3 通過抑制 CLU 的溶酶體降解來穩定 CLU 蛋白[6]。

圖 4. PRKD3 inhibits degradation of CLU via inhibiting lysosomal pathway not proteasomal pathway[6]

參考文獻及鳴謝
[1] P.M.P. Ferreira, R.W.R.d. Sousa, J.R.d.O. Ferreira, G.C.G. Militão, D.P. Bezerra, Chloroquine and hydroxychloroquine in antitumor therapies based on autophagy-related mechanisms, Pharmacological Research 168 (2021) 105582.
[2] L. Mo, P. Zheng, [Chloroquine phosphate: therapeutic drug for COVID-19], Nan Fang Yi Ke Da Xue Xue Bao 40(4) (2020) 586-594.
[3] M. Wang, R. Cao, L. Zhang, X. Yang, J. Liu, M. Xu, Z. Shi, Z. Hu, W. Zhong, G. Xiao, Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro, Cell Res 30(3) (2020) 269-271.
[4] M. Al-Hamadani, M. Darweesh, S. Mohammadi, A. Al-Harrasi, Chloroquine and hydroxychloroquine: Immunomodulatory effects in autoimmune diseases, World J Biol Chem 16(2) (2025) 107042.
[5] J. Zhao, Z. Xu, J. Xie, T. Liang, R. Wang, W. Chen, C. Mi, P. Tian, J. Guo, H. Zhang, The novel lnc-HZ12 suppresses autophagy degradation of BBC3 by preventing its interactions with HSPA8 to induce trophoblast cell apoptosis, Autophagy 20(10) (2024) 2255-2274.
[6] Y. Liu, Y. Zhou, X. Ma, L. Chen, Inhibition Lysosomal Degradation of Clusterin by Protein Kinase D3 Promotes Triple-Negative Breast Cancer Tumor Growth, Adv Sci (Weinh) 8(4) (2021) 2003205.
標簽:
抑制劑
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com