通過腫瘤類器官與免疫細(xì)胞共培養(yǎng)誘導(dǎo)腫瘤特異性T細(xì)胞產(chǎn)生的研究
近年來,腫瘤免疫療法在癌癥治療中非常火熱。腫瘤免疫學(xué)治療的目的是激發(fā)或調(diào)動機體的免疫系統(tǒng),增強腫瘤微環(huán)境抗腫瘤免疫力,從而控制和殺傷腫瘤細(xì)胞。隨著免疫治療的興起也推動了腫瘤研究的發(fā)展,但是由于人源化體系的復(fù)雜性、免疫系統(tǒng)的部分或無效重組建等問題,致使免疫腫瘤模型面臨著巨大的挑戰(zhàn),臨床上迫切需要能夠用于個體化驗證療效的體外模型。類器官的出現(xiàn)給腫瘤免疫治療提供了新的契機,然而,現(xiàn)有的類器官中缺乏免疫細(xì)胞限制了其發(fā)展。

一項發(fā)表于頂刊Cell題為《Generation of Tumor-Reactive T Cells by Co-culture of Peripheral Blood Lymphocytes and Tumor Organoids》的研究性論文為這個問題的解決提供了新的策略。
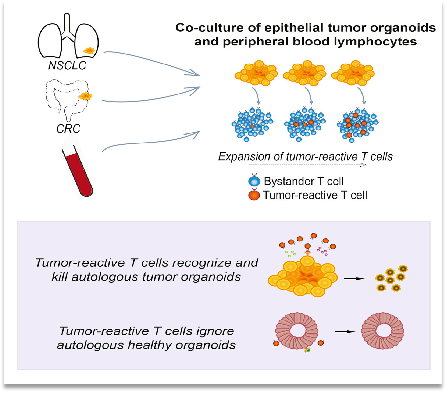
研究人員通過來自患者的自體腫瘤構(gòu)建的類器官和外周血淋巴細(xì)胞共同培養(yǎng),建立一個能夠特異性誘導(dǎo)分析腫瘤免疫反應(yīng)的平臺,為分離評估腫瘤免疫中T細(xì)胞提供了新的方法,文章的三大亮點:
(二)誘導(dǎo)的T細(xì)胞不會特異性識別正常的類器官或組織。
(三)該平臺可用于評估體外誘導(dǎo)的T細(xì)胞介導(dǎo)對腫瘤細(xì)胞的殺傷效率。
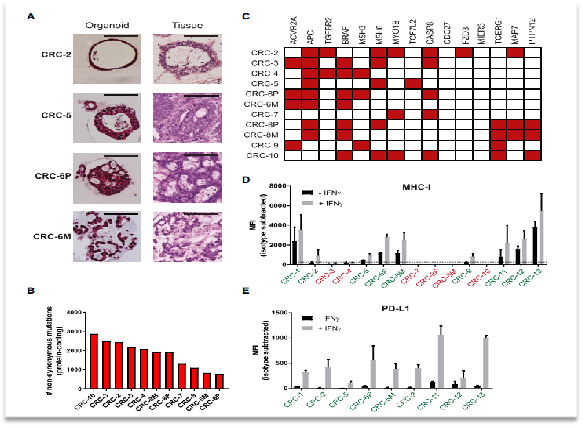
首先,研究人員從13 名錯配修復(fù)基因缺陷型(dMMR)結(jié)直腸癌患者(dMMR CRC)體內(nèi)分離15 個腫瘤類器官,成功率為60%。通過對原始腫瘤樣本和腫瘤類器官進(jìn)行免疫組化檢測和全外顯子測序,說明了類器官培養(yǎng)過程中與原發(fā)腫瘤的組織學(xué)和突變特征保持一致性。另外作者對MHC表達(dá)量進(jìn)行了篩選,最終獲得9例樣本,流式細(xì)胞術(shù)測定PD-L1表達(dá),然后用IFNγ進(jìn)行刺激,發(fā)現(xiàn)MHC-1類分子的缺失不是類器官的一般特征。
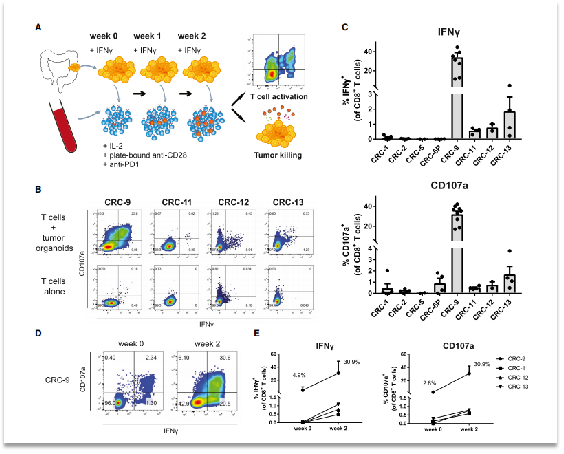
進(jìn)一步地,為了評估該腫瘤類器官是否可用于獲得腫瘤特異性 T 細(xì)胞。研究人員構(gòu)建了“腫瘤類器官-外周血淋巴細(xì)胞”共培養(yǎng)模型。其中,外周血單個核細(xì)胞(PBMC) 從 dMMR CRC 患者中分離出來,并每周使用自體腫瘤類器官刺激。通過對CD8+ T 細(xì)胞效應(yīng)分子 IFNγ 和CD107a進(jìn)行染色分析,在共培養(yǎng) 2 周后評估CD8 + T 細(xì)胞對腫瘤的識別情況。
結(jié)果表明在 8個MHC-1 陽性腫瘤類器官中,有 4 個(50%)在共培養(yǎng) 2 周后,IFNγ 和CD107a發(fā)生了上調(diào)。而在MHC I 類缺陷類器官中沒有發(fā)生上調(diào),并且與類器官刺激前相比,CD8+ T 細(xì)胞群增加了10倍。這些結(jié)果表明了該系統(tǒng)可以用于產(chǎn)生評估腫瘤特異性 T細(xì)胞亞群。
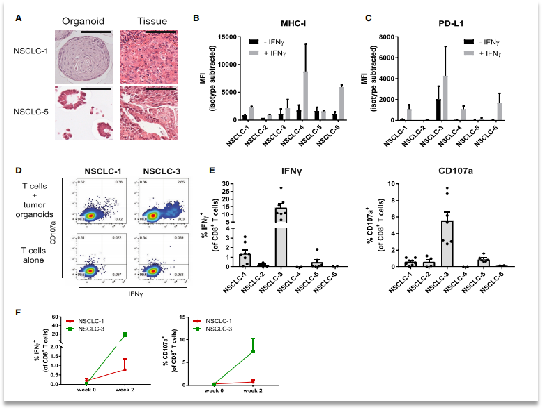
進(jìn)一步地,研究人員又使用非小細(xì)胞肺癌對該系統(tǒng)的廣譜性進(jìn)行了分析。通過前述類似的方法,研究人員在培養(yǎng)兩周后也觀察到了CD8+ T 細(xì)胞群進(jìn)行了擴大。
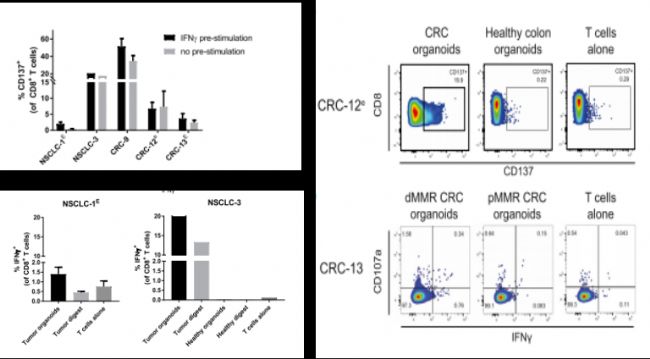
研究人員還做了進(jìn)一步驗證,通過流式細(xì)胞術(shù)對T細(xì)胞、腫瘤類器官和正常類器官進(jìn)行比對,得到結(jié)果無論是否添加IFNγ對T細(xì)胞的誘導(dǎo)是沒有影響的。
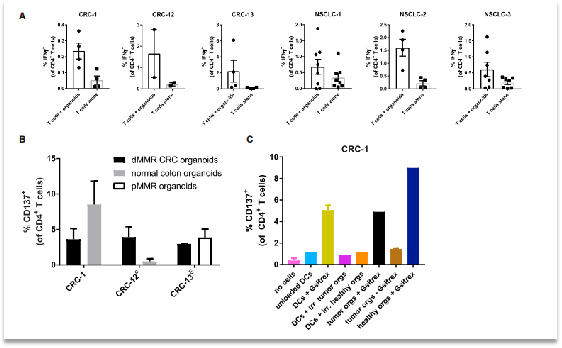
同時作者還進(jìn)一步進(jìn)行了T細(xì)胞的特異性殺傷性驗證,發(fā)現(xiàn)類器官的正常組織和T細(xì)胞免疫共培養(yǎng)也具有免疫殺傷性,因此作者開始尋找原因,發(fā)現(xiàn)培養(yǎng)類器官使用的基質(zhì)膠中含有鼠源成分,對此作者又設(shè)計了1組實驗來驗證是否是這種成分導(dǎo)致T細(xì)胞的特異性激活,結(jié)果顯示添加基質(zhì)膠對T細(xì)胞的激活是有直接影響的。
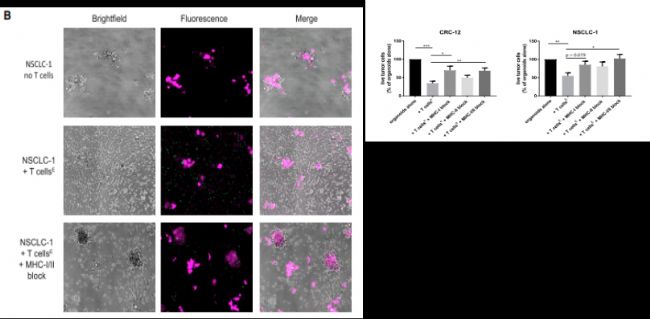
文章最后對MHCⅠ/Ⅱ的影響進(jìn)行了研究,發(fā)現(xiàn)MHCⅠ/Ⅱ?qū)細(xì)胞的特異性殺傷性是有阻斷作用的。
綜上,這些結(jié)果表明:通過腫瘤類器官與免疫細(xì)胞共培養(yǎng)可以有效誘導(dǎo)腫瘤特異性T細(xì)胞的產(chǎn)生。這一研究也極大拓展了類器官在腫瘤免疫中的應(yīng)用,為解決類器官免疫細(xì)胞缺失問題提供了新的策略。
- 脂肪肝造模如何實現(xiàn)一站式服務(wù)?試劑盒全流程解析
- CD3復(fù)合物的特性與功能、信號傳導(dǎo)機制及在腫瘤免疫治療中的應(yīng)用
- CD274基因擴增的作用機制及在肺癌治療中的研究進(jìn)展
- 肝素鈉Heparin實現(xiàn)動物實驗高效抗凝與抗炎的機制及應(yīng)用案例
- 心肌缺氧應(yīng)激介導(dǎo)功能性心臟細(xì)胞外囊泡釋放機制及其臨床意義
- CD103⁺/CD141⁺樹突狀細(xì)胞通過CCR7依賴性機制驅(qū)動免疫應(yīng)答的機制
- GelNest™ 基質(zhì)膠助力腫瘤生物學(xué)行為的研究和評價
- 創(chuàng)傷修復(fù)與組織再生關(guān)鍵調(diào)控因子bFGF的作用機制及應(yīng)用