白細胞介素-2(IL-2)的發展歷程、生物學特性及在生物制藥方面的應用

白細胞介素-2(IL-2)的發現歷程
· 1974 年:IL-2 被發現。當時,科學家們在研究 T 細胞的生長和分化過程中,觀察到一種能夠促進 T 細胞增殖的因子存在于 T 細胞培養上清液中,但尚未對其進行純化和深入研究。
· 1976 年:NCI 腫瘤細胞生物學實驗室的 Robert Gallo 使用 PHA 刺激淋巴細胞產生條件培養基培養骨髓細胞,發現其中未被純化的成分可維持 T 細胞長達 9 個月的生存,這個成分被稱之為 T 細胞生長因子(TCGF),這是 IL-2 研究的重要進展。
· 1980 年:Robert Gallo 通過離子交換色譜和凝膠分離,從條件培養基中分離濃縮了 TCGF,并得出了大致的分子量約 15kd,這使得 IL-2 的研究向前邁進了一大步。
· 1983 年:
· 日本癌癥研究基金會腫瘤研究中心的 Junji Hamuro 等人克隆了 IL-2 的基因,并完成了測序工作,人們由此可以完整地了解這個 T 細胞生長因子的基因和氨基酸序列等基礎信息。
· 多個實驗室進行了 IL-2 的大腸桿菌表達,這為 IL-2 的進一步研究和應用奠定了基礎。
· 1984 年:Nature 發表了三篇關于 IL-2 受體 α 克隆的文章,分別來自于 Immunex 公司(2002 年被 Amgen 收購)、NCI 和日本京都大學,這標志著對 IL-2 作用機制的研究取得了重要突破,開始深入到受體層面。
· 1985 年:
· Rosenberg 等在新英格蘭醫學雜志報道,使用 IL-2 和 LAK 細胞進行了 25 個癌癥轉移病人的臨床研究,顯示出 IL-2 在腫瘤治療方面的潛在應用價值。
· Rosenberg 在肝癌轉移小鼠模型注射重組 IL-2,獲得了很好的治療效果。
· 1986 年:
· NIH 國立兒童健康與人類發育研究所發現了 IL-2 另外一個受體 p70,1986 和 1987 年還有多篇文章報道 IL-2 p70 受體,進一步豐富了對 IL-2 受體的認識。
· 科學家們發現 T 細胞的激活需要來自 TCR 和 CD28 的信號,此后 CD28 被命名為 “共刺激分子”。
· 1990 年:日本東北大學醫學院和京都大學分別發表文章發現 IL-2Rγ,至此,IL-2 受體 α、β、γ 被全部發現。
· 1991 年:諾華與 Linigen 聯合研發的重組 IL-2 藥物 Proleukin(aldesleukin,阿地白介素)被 FDA 批準治療轉移性腎癌,1998 年批準治療轉移性黑色素瘤。
· 1992 年:IL-2 獲得批準并成為第一個免疫療法。
IL-2 的發現為免疫學和腫瘤免疫治療等領域的發展奠定了重要基礎,后續圍繞 IL-2 及其受體的研究不斷深入,推動了相關疾病治療方法的探索和發展。
IL-2的生物學特性
白細胞介素 - 2(IL-2)的生物學特性主要包括以下幾個方面:
一、產生細胞及誘導因素
· IL-2 主要由活化的 T 淋巴細胞產生,尤其是 CD4+T 細胞和 CD8+T 細胞。當 T 細胞受到抗原、有絲分裂原(如植物血凝素、刀豆蛋白 A 等)等刺激后,便開始合成和分泌 IL-2。此外,自然殺傷(NK)細胞在一定條件下也能產生少量的 IL-2。
二、分子結構與理化性質
· IL-2 是一種分子量約為 15-20 kDa 的糖蛋白,其蛋白結構包含多個重要的功能區域:
· 含有多個半胱氨酸殘基,形成分子內的二硫鍵,對于維持其空間結構和生物學活性至關重要。
· 具有特定的氨基酸序列,這些序列決定了其與受體的結合能力以及生物學功能的發揮。
· 在溶液中,IL-2 表現出一定的溶解性和穩定性特點,在適宜的 pH 值和離子強度條件下能夠保持其活性。
三、受體結合及信號轉導
· 1. IL-2 受體組成
· IL-2 受體是一個由多條多肽鏈組成的復合體,包括 α 鏈(CD25)、β 鏈(CD122)和 γ 鏈(CD132):
· α 鏈:也稱為 T 細胞活化蛋白 p55,相對分子質量為 55 kDa,是低親和力受體的主要組成部分。單獨的 α 鏈與 IL-2 的結合親和力較低,但在調節受體的表達和功能方面起著重要作用。
· β 鏈:相對分子質量約為 75 kDa,與 IL-2 結合后可以增加受體對 IL-2 的親和力,并且在信號轉導過程中起著關鍵作用。
· γ 鏈:相對分子質量約為 64 kDa,是多種細胞因子受體共用的信號轉導亞單位,對于 IL-2 介導的信號傳遞至細胞內起著不可或缺的作用。
· 不同細胞表面 IL-2 受體的組成和表達水平有所差異,例如活化的 T 細胞和 B 細胞表面高表達 IL-2 受體的三聚體形式(αβγ),具有高親和力;而靜止的 T 細胞和 NK 細胞表面主要表達由 β 鏈和 γ 鏈組成的二聚體受體,親和力相對較低。
· 2. 結合特性與親和力
· IL-2 與受體的結合具有特異性和可飽和性。其結合親和力受到受體組成、細胞活化狀態以及其他因素的影響:
· 當 IL-2 受體以三聚體形式存在時,與 IL-2 的結合親和力高,解離常數(Kd)可達 10-11mol/L 級別;而二聚體受體與 IL-2 的結合親和力相對較低,Kd 約在 10-8mol/L 至 10-9mol/L 之間。
· 3. 信號轉導途徑
· IL-2 與受體結合后,通過激活一系列細胞內信號轉導通路,將信號傳遞至細胞核內,調節基因的表達,從而發揮其生物學效應:
· JAK-STAT 途徑:這是 IL-2 信號轉導的主要途徑之一。IL-2 受體的 β 鏈和 γ 鏈胞內區與 Janus 激酶(JAK)家族成員(如 JAK1、JAK3)相結合。當 IL-2 與受體結合后,JAK 激酶被激活,進而磷酸化信號轉導及轉錄激活蛋白(STAT)家族成員,特別是 STAT5。磷酸化的 STAT5 形成二聚體,轉移至細胞核內,與特定的 DNA 序列結合,調節一系列與細胞增殖、分化和存活相關基因的表達。
· PI3K-AKT 途徑:IL-2 受體激活后,還可以通過 PI3K(磷脂酰肌醇 3 - 激酶)介導的信號通路調節細胞的代謝和存活。PI3K 被激活后,產生第二信使 PIP3(磷脂酰肌醇 - 3,4,5 - 三磷酸),進而激活 AKT(蛋白激酶 B)等下游分子。AKT 可以調節多種細胞功能,如促進細胞存活、代謝調節以及蛋白質合成等。
· RAS-MAPK 途徑:IL-2 也可以激活 RAS(一種小 G 蛋白),進而啟動 MAPK(絲裂原活化蛋白激酶)級聯反應。MAPK 信號通路參與調節細胞的增殖、分化和應激反應等多種生物學過程。通過激活 ERK(細胞外信號調節激酶)、JNK(c-Jun 氨基末端激酶)和 p38 等 MAPK 家族成員,將信號傳遞至細胞核內,調節相關基因的表達。
· 這些生物學特性使得 IL-2 在免疫系統中發揮著關鍵的調節作用,參與了免疫細胞的增殖、分化和功能調節等重要生理過程。
IL-2生物制藥方面的應用
· 1. 治療癌癥:
· 刺激免疫細胞活性:IL-2 能促進 T 細胞的增殖和分化,維持 T 細胞活性,刺激 NK 細胞的生成、增殖和活化,并誘導細胞毒性 T 淋巴細胞的生成,誘導和激活淋巴因子激活的殺傷細胞及腫瘤浸潤淋巴細胞,這些免疫細胞可以攻擊和殺死癌細胞。
· 聯合治療:與其他抗癌藥物如 PD-1 抑制劑聯合使用。例如信達生物的 PD-1/IL-2 雙抗(IBI363),通過激活和擴展類似效應 CD8+T 和 NK 細胞等免疫因子,使 “冷腫瘤” 轉變為 “熱腫瘤”,增強對 PD-1 抗性腫瘤細胞的殺傷;還有君實生物通過授權獲得的 IL-2 系列產品,可與 PD-1 單抗聯合,有利于 PD-1 單抗市場下一階段的競爭。
· 2. 治療自身免疫性疾病:
· 調節免疫平衡:IL-2 對免疫系統有調節作用,可通過調節 T 細胞和調節性 T 細胞(Treg 細胞)的功能來抑制過度活躍的免疫反應。研究發現,針對 IL-2 的不同單克隆抗體可以促進小鼠中不同類型的 T 細胞擴增,某些抗體與 IL-2 結合使用可有效治療自身免疫性疾病和炎癥,目前有一種類似的人單克隆抗體正往臨床試驗發展。
· 靶向特定細胞類型:利用工程化的 IL-2 生物制劑,選擇性地靶向 Treg 細胞,以對抗自身免疫和炎癥性疾病中失調的免疫系統。例如一些 IL-2 類似物通過改變 IL-2 與其受體的結合特性,使其更特異性地作用于 Treg 細胞,從而減輕自身免疫反應。
· 3. 增強疫苗效果:
· 作為疫苗佐劑,增強機體對疫苗的免疫應答。例如在新城疫活疫苗基因組中引入分子佐劑雞 IL2,能夠在疫苗免疫早期刺激雞體內產生 NDV 抗體并增強體液免疫水平,提升免疫保護效率。
IL-2的局限性和解決方案
· 1. 局限性:
· 半衰期短:天然 IL-2 的半衰期很短(通常小于 15 分鐘),這導致在治療過程中需要頻繁給藥,增加了患者的負擔和治療成本,且可能影響患者的依從性。
· 毒性問題:使用高劑量 IL-2 治療癌癥時,會引起嚴重的非特異性毒性,可能出現如低血壓、急性腎功能衰竭等嚴重的并發癥,還可能有發熱、畏寒、疲乏感、惡心嘔吐等常見副作用,對患者的身體造成較大負擔,甚至可能危及生命。
· 免疫調節復雜性:IL-2 雖然可以激活免疫細胞發揮抗腫瘤等作用,但它同時也能激活 Treg 細胞,而腫瘤微環境中的 Treg 細胞通常起到免疫抑制的作用,可能會抵消 IL-2 激發的抗癌免疫反應,影響治療效果。
· 藥代動力學特性欠佳:藥物在體內的吸收、分布、代謝和排泄過程不夠理想,可能導致藥物在體內的濃度不穩定,影響療效的發揮,且可能增加藥物的副作用。
· 2. 解決方案:
· 工程化改造 IL-2:IL-2 突變體:通過引入基因突變,改變 IL-2 蛋白表面的特定氨基酸,生成傾向與高親和力受體或中親和力受體結合的 IL-2 突變體。例如安進公司的 efavaleukin alfa,將攜帶特定突變的 IL-2 與抗體的 Fc 端融合在一起,構成的融合蛋白不但具有更長的半衰期,而且傾向與高親和力受體相結合,能夠促進 Treg 細胞的增生,從而恢復自身免疫疾病患者的免疫平衡。
· 聚乙二醇修飾的 IL-2:將聚乙二醇(PEG)偶聯在 IL-2 蛋白表面可以延長 IL-2 蛋白的半衰期。通過控制聚乙二醇在 IL-2 表面偶聯的位置和數量,可以構建出傾向與高親和力受體或者中親和力受體結合的 IL-2 類似物。如 Nektar Therapeutics 公司開發的 bempegaldesleukin(NKTR-214),通過在 IL-2 與 CD25 結合的界面附近平均偶聯 6 個 PEG 鏈,阻斷了它與高親和力 IL-2R 受體的結合,更傾向于激活 CD8 陽性記憶 T 細胞和 NK 細胞。為解決部分 PEG 修飾的 IL-2 存在的 PEG 修飾位點不一致的問題,有些生物技術公司在 IL-2 表面引入非天然氨基酸,將 PEG 鏈偶聯在這些非天然氨基酸上,以生成同質化更強的 IL-2 類似物,如賽諾菲公司的 SAR444245。
· IL-2 免疫復合體:IL-2 與抗 IL-2 單抗結合構成復合體,既可以延長 IL-2 蛋白半衰期,又能調節 IL-2 的受體結合選擇性。例如 Anaveon 公司開發的選擇性 IL-2R 激動劑 ANV419。
· 聯合用藥:將 IL-2 與其他藥物聯合使用,以提高療效或減輕副作用。比如與 PD-1 抑制劑等免疫檢查點抑制劑聯合應用,增強抗腫瘤效果;或與其他具有協同作用的藥物聯合,改善患者的免疫狀態。
· 優化給藥方式:探索更合適的給藥途徑和方案,如采用緩釋制劑、局部給藥等方式,減少藥物的全身暴露,降低副作用,同時提高藥物在局部的濃度和作用時間。
· 精準醫療策略:根據患者的個體差異,如基因表達譜、免疫狀態等,制定個性化的治療方案,選擇適合患者的 IL-2 制劑、劑量和給藥方式,以提高治療效果并減少不良反應。
· 開發新型藥物:研究和開發具有類似 IL-2 功能但克服其局限性的新型藥物,或者利用基因編輯等技術對 IL-2 的作用機制進行深入研究和改造,以創造出更高效、安全的治療藥物。
IL-2工程化改造方案
一、蛋白質工程改造
· 1. 突變體設計
· 改變受體結合特性:
· 通過對 IL-2 蛋白關鍵氨基酸位點進行定點突變,可以改變其與不同受體亞基的結合親和力。例如,將某些關鍵位點的氨基酸殘基進行替換,使其更傾向于與高親和力受體(由 αβγ 鏈組成)中的 βγ 鏈結合,這樣可以增強對效應 T 細胞和 NK 細胞的激活作用,同時減少對調節性 T 細胞(Tregs)的過度刺激。
· 設計突變體以降低與 α 鏈(CD25)的結合能力,從而減少對 Tregs 的優先激活,使 IL-2 更多地作用于具有抗腫瘤活性的免疫細胞,增強其在癌癥免疫治療中的效果。
· 增加穩定性:
· 在 IL-2 的結構中引入額外的二硫鍵或對現有的二硫鍵進行優化,以提高蛋白質的熱穩定性和抗蛋白酶降解能力。這可以延長 IL-2 在體內的半衰期,減少給藥頻率。
· 對 IL-2 蛋白表面的氨基酸進行修飾,使其具有更優化的親水性或疏水性分布,改善蛋白質的折疊穩定性和在溶液中的穩定性。
· 2. 融合蛋白構建
· 與抗體片段融合:
· 將 IL-2 與抗體的 Fc 片段融合,形成 IL-2-Fc 融合蛋白。Fc 片段可以延長 IL-2 在體內的半衰期,通過與新生 Fc 受體(FcRn)結合,避免被腎臟快速清除。同時,抗體部分還可以提供靶向特定細胞或組織的功能,例如可以設計針對腫瘤相關抗原的雙特異性抗體,其中一端結合腫瘤抗原,另一端融合 IL-2,實現將 IL-2 精準遞送到腫瘤微環境中,提高局部免疫激活效果,降低全身毒性。
· 利用抗體的可變區片段(scFv)與 IL-2 融合,構建具有靶向特定細胞類型能力的融合蛋白。例如,設計針對特定免疫細胞表面標志物的 scFv-IL-2 融合蛋白,實現對特定免疫細胞群體的選擇性激活。
· 與其他蛋白或多肽融合:
· 將 IL-2 與其他細胞因子或免疫調節蛋白融合,形成具有協同作用的多功能融合蛋白。例如,將 IL-2 與 IL-15 融合,IL-15 也是一種重要的免疫細胞生長因子,兩者融合后可以同時激活多種免疫細胞,增強免疫應答效果。
· 與具有延長半衰期功能的多肽融合,如與白蛋白結合多肽融合,利用白蛋白在體內的長循環特性,延長 IL-2 的作用時間。
二、聚乙二醇化修飾
· 1. 位點選擇和優化:
· 通過化學方法將聚乙二醇(PEG)分子連接到 IL-2 蛋白的特定氨基酸殘基上。選擇合適的位點進行 PEG 修飾至關重要,一般選擇在對 IL-2 生物活性影響較小的表面暴露區域進行修飾。例如,選擇遠離與受體結合關鍵區域的氨基酸位點進行 PEG 偶聯,以盡量減少對 IL-2 與受體結合能力的影響。
· 優化 PEG 的分子量和連接方式(如直鏈 PEG 或支鏈 PEG),以獲得藥代動力學特性和生物活性平衡。較大分子量的 PEG 通常可以提供更長的半衰期,但可能會對生物活性產生更大的影響,因此需要根據具體需求進行優化選擇。
· 2. 控制修飾程度:
· 精確控制 PEG 與 IL-2 的偶聯比例,確保修飾后的產物具有一致的質量和性能。可以通過優化反應條件和純化工藝,實現對 PEG 修飾程度的精確控制。例如,采用特定的化學反應條件和純化方法,使每個 IL-2 分子上連接的 PEG 分子數量保持在一個合理的范圍內,以保證修飾后的 IL-2 具有良好的生物活性和藥代動力學特性。
· 對修飾后的 IL-2 進行質量檢測和分析,確保產品的一致性和穩定性。采用先進的分析技術,如質譜分析、高效液相色譜等,對 PEG 修飾的 IL-2 進行詳細的結構和質量表征,以監控生產過程中的質量變化。
三、構建 IL-2 免疫復合體
1. 與抗體結合形成免疫復合體:
利用特異性抗 IL-2 抗體與 IL-2 結合形成免疫復合體。這種免疫復合體可以改變 IL-2 的生物活性和藥代動力學特性。例如,某些抗 IL-2 抗體可以選擇性地調節 IL-2 與不同受體亞基的結合,從而改變其對免疫細胞的激活模式。
設計具有特定功能的抗 IL-2 抗體,如可以優先促進 IL-2 與效應 T 細胞表面受體結合的抗體,與 IL-2 結合形成免疫復合體后,增強對效應 T 細胞的激活作用,提高抗腫瘤免疫應答。
通過對抗體的結構和親和力進行優化,調節免疫復合體的穩定性和生物活性。例如,改變抗體的可變區序列,提高其與 IL-2 的結合親和力和特異性,以獲得更理想的免疫復合體性能。
2. 利用其他分子構建復合體:
除了抗體,還可以利用其他生物分子或化學分子與 IL-2 構建復合體。例如,使用脂質體、聚合物納米顆粒等載體材料將 IL-2 包裹或吸附在其表面,形成具有特定釋放特性和靶向能力的復合體。這些載體可以保護 IL-2 免受體內酶的降解,延長其作用時間,并可以通過表面修飾實現對特定組織或細胞的靶向遞送。
利用生物相容性聚合物或凝膠材料與 IL-2 結合,形成可注射的緩釋制劑。這些緩釋制劑可以在體內逐漸釋放 IL-2,維持一定的藥物濃度,減少給藥次數,同時提高患者的依從性。
四、基于基因工程的改造
1. 表達載體優化:
設計和構建高效的 IL-2 基因表達載體,用于在生物體內或體外生產 IL-2。優化表達載體的啟動子、增強子和其他調控元件,以提高 IL-2 的表達水平和穩定性。例如,使用強啟動子如 CMV 啟動子或組織特異性啟動子,根據應用場景選擇合適的表達系統,如細菌、酵母、哺乳動物細胞等表達系統,以滿足不同的生產需求和藥物質量要求。
在表達載體中引入融合標簽或信號肽序列,便于 IL-2 的表達、純化和分泌。例如,添加 His 標簽用于后續的蛋白純化,或添加特定的信號肽序列,促進 IL-2 在細胞內的正確折疊和分泌到細胞外。
2. 基因編輯技術應用:
利用基因編輯技術如 CRISPR/Cas9 對 IL-2 基因進行精確修飾,以改變其編碼的蛋白質結構和功能。例如,可以在 IL-2 基因中引入特定的突變,實現對其生物活性、受體結合特性等方面的定制化改造。
通過基因編輯技術在細胞內直接對 IL-2 及其相關信號通路進行調控。例如,在免疫細胞中敲除或敲入與 IL-2 信號傳導相關的基因,以研究其對免疫細胞功能的影響,并為設計更有效的 IL-2 治療策略提供依據。
3. 基因治療策略:
將 IL-2 基因導入患者體內的細胞,實現體內持續表達 IL-2。可以使用病毒載體(如腺病毒、慢病毒等)或非病毒載體(如質粒 DNA、納米顆粒等)將 IL-2 基因遞送到目標細胞中。例如,在腫瘤免疫治療中,將 IL-2 基因導入腫瘤浸潤淋巴細胞(TILs)或其他免疫細胞中,增強其抗腫瘤活性。
利用基因調控元件控制 IL-2 基因的表達時間和水平。例如,使用可誘導的啟動子系統,根據患者的治療需求和病情發展,在特定的時間點或在特定的刺激條件下啟動 IL-2 基因的表達,以實現精準的治療控制,同時減少潛在的副作用。
逐典高活性偏向性IL-2
逐典生物研發團隊具有十多年跨國公司工作經驗,在蛋白分子結構設計方面具有豐富的經驗,曾將多個蛋白新分子藥物推至臨床階段。逐典生物研發團隊憑借專有的蛋白設計平臺,開發出具有偏向性的IL-2,通過改變與α、β和γ三種不同受體的親和力實現優先高效激活CD8+T細胞或者高效優先激活Treg細胞。不論通過展示在免疫細胞表面,抑或是從人體分離相關免疫細胞中使用,偏向型IL-2的使用會更有效地滿足細胞藥物研發需求
下面以逐典生物IL-2 AID為例,展示其優先激活Treg細胞的相關數據(其他更多偏向性細胞因子信息,歡迎聯系技術熱線15951985773)。
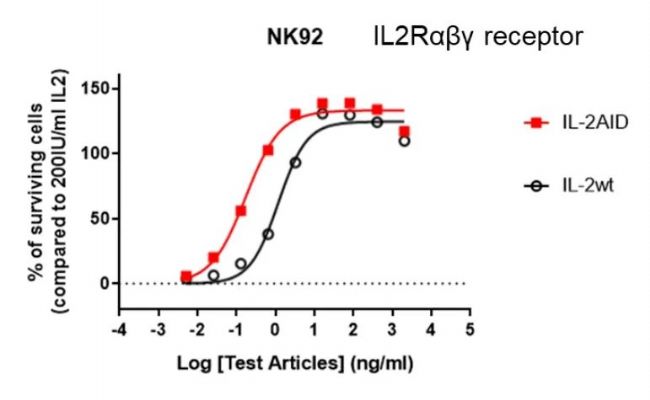
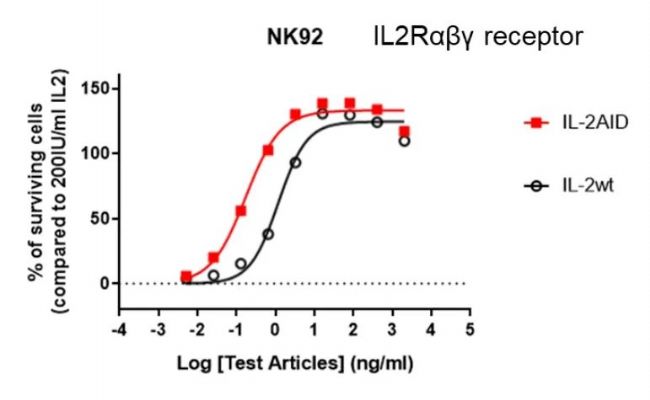
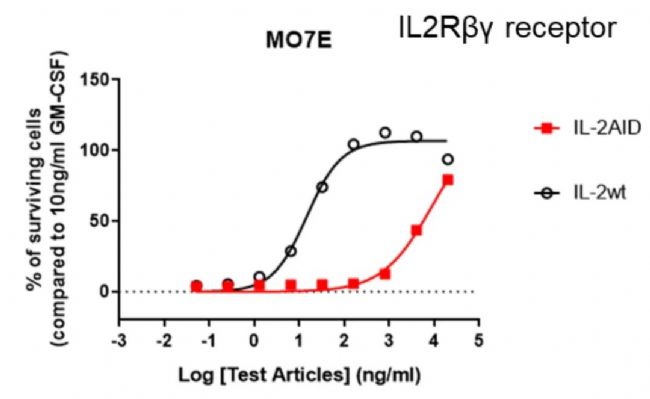
圖1. IL-2 AID分子更易使穩定表達有αβγ受體的細胞增殖
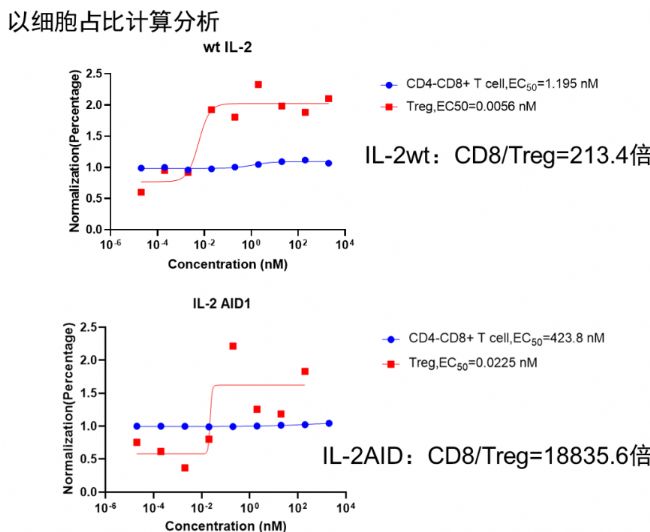
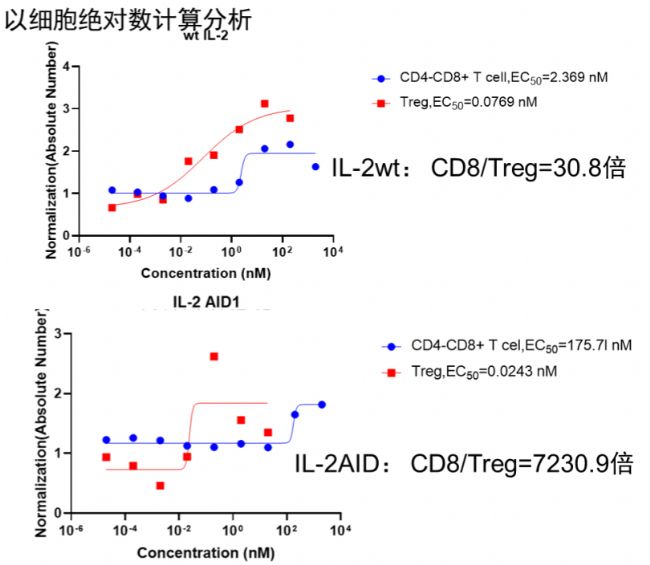
圖2. 體外刺激人PBMC結果顯示,IL-2 AID分子可以優先刺激Treg增殖,與IL-2 WT相比,CD8+ T和Treg ED50差值明顯增大