氧電極Nature發文光合碳同化關鍵酶Rubisco相變機制重要突破

**23 January 2019;DOI:https://doi.org/10.1038/s41586-019-0880-5**
核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)是光合作用碳同化關鍵酶,在藻類、植物以及部分光合細菌中保守存在。Rubisco是植物葉片中含量最豐富的蛋白質,也是地球上含量最多的蛋白質。Rubisco固碳效率非常低,是光合作用的限速酶,而藻類和少數植物可以利用二氧化碳濃縮機制(CO2-concentrating mechanism, CCM)以提高碳同化效率。
藍細菌的α-和β-羧酶體含有由八個大亞基(RbcL)和八個小亞基(RbcS)組成的Rubisco以及碳酸酐酶復合物。由于HCO3-可以通過擴散進入羧酶體外殼而CO2不能,碳酸酐酶復合物因此可以產生高濃度的CO2用于Rubisco的碳固定。羧酶體外殼還可以防止還原劑進入,產生并保持內部的氧化環境。β-羧酶體的形成涉及由CcmM蛋白介導的Rubisco聚集。
CcmM蛋白以兩種形式存在:其一為M58,發現于細胞聚球藍細菌中全長的CcmM,N端包含有碳酸酐酶樣(carbonicanhydrase-like,CA)結構域,隨后是三個通過柔性linker連接Rubisco小亞基樣(Rubisco small subunit-like,SSUL)模塊;另一種為M35缺乏碳酸酐酶樣(CA)結構域(圖2g)。一直以來,人們認為SSUL模塊通過替換RbcS與Rubisco相互作用。但是,真實的情況和具體的分子機制并不清楚。

近期,德國馬普生化所Manajit Hayer-Hartl課題組在Nature雜志在線發表了題為Rubiscocondensate formation by CcmM in β-carboxysome biogenesis的研究論文,報導了Rubisco-CcmM復合物結構,并且通過生理實驗驗證了Rubisco在β-羧酶體生物發生過程中由CcmM介導的相變過程的分子機制。

此前有文章報道細胞通過一些使酶區域化的機制,作為調節代謝途徑和提高其效率的策略。近期研究的熱點相變是這個區域化作用的一種突出體現。
在這篇文章中,Hayer-Hartl課題組的研究人員不僅重組了Rubisco-CcmM復合物,解析了它的結構,還觀測到了Rubisco相變過程對于酶活的重要性。了解羧酶體的生物發生對于未來將二氧化碳濃縮機制引入植物中具有重要意義。
此前的推測是SSUL模塊通過替換RbcS與Rubisco相互作用,而從解析的Rubisco-CcmM復合物結構來看,SSUL模塊結合在RbcL二聚體之間靠近Rubisco的“赤道”區域,連接Rubisco分子并誘導相分離成液體狀基質。
他們首先解析了藍細菌中CcmM的SSUL1的晶體結構(圖1a),SSUL1與此前報導的RbcS結構同源,但是序列不同源(圖1b)。并且,此結構是氧化狀態下的結構,可以看到Cys261和Cys279之間的二硫鍵。同時,他們也解析了還原狀態下的SSUL1結構,除了沒有二硫鍵,其他與氧化狀態下一致。
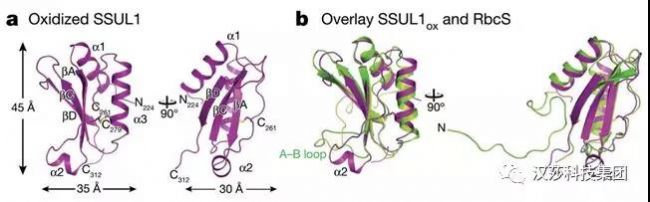
圖1. SSUL1的氧化狀態晶體結構和M35介導的與Rubisco形成的網絡結構。a:Se7924中CcmMD的氧化態SSUL1(旋轉90°雙視圖);b:SSUL1(洋紅)與Se6301的RbcS(綠色)形成的網絡結構
通過生化實驗,他們發現Rubisco和M35按一定比例混合會變渾濁,形成聚集網絡,并且驗證該復合物是有功能的。但同時也發現,不管是單獨的SSUL,還是M13-1,M13-2或M13-3(圖2g),都不能形成該網絡。只有M24-1/2(SSUL1&SSUL2)組合才能介導Rubisco網絡形成(圖2h,i)。
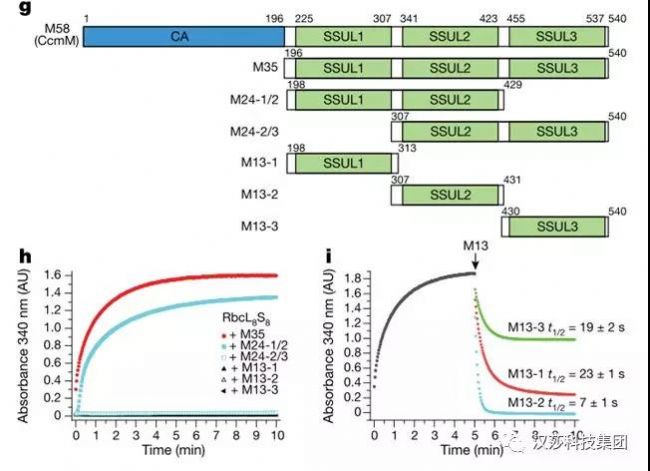
圖2. M58和M35的結構域截短組合和Rubisco-M35的結合&解離生化實驗
接著他們發現Rubisco-M35的網絡動態特性表明這些蛋白質經歷了液-液相分離(LLPS)。通過熒光實驗,將Rubisco和M35red按一定比例組合,可誘導分層成圓形熒光冷凝物,符合液滴的特征,確定是LLPS現象。與Rubisco在綠藻類淀粉核中的行為類似,在更具活力的氧化條件下,M35可將Rubisco濃縮成液體基質,與羧酶體中的狀態一致。
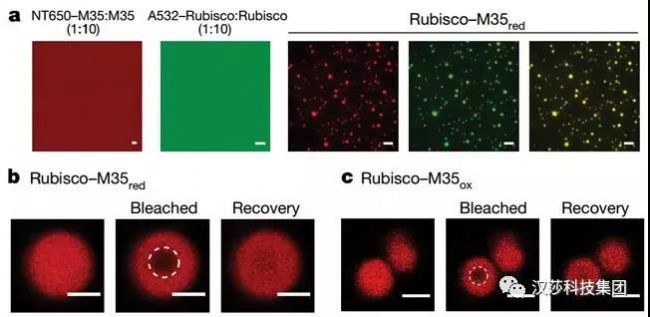
圖3. Rubisco凝結成具有液體特性的網絡
研究發現,在晶體結構中看到的SSUL中的二硫鍵對于羧酶體的生物學功能很重要,它增加了基質網絡的靈活性,并且是體內羧基體功能所必需的。
通過使用Cholorolab2+液相氧電極(英國,Hansatech),評估野生型和突變型Se7942菌株對無機碳(Ci)的光合親和力差異,評估其在Ci濃度范圍內的O2釋放速率。突變掉相關的Cys,將SSUL1或SSUL2中二硫鍵的破壞,會導致羧酶體對CO2的需求量增加約10至20倍,倍增的時間增加約2至2.5倍(圖4)。
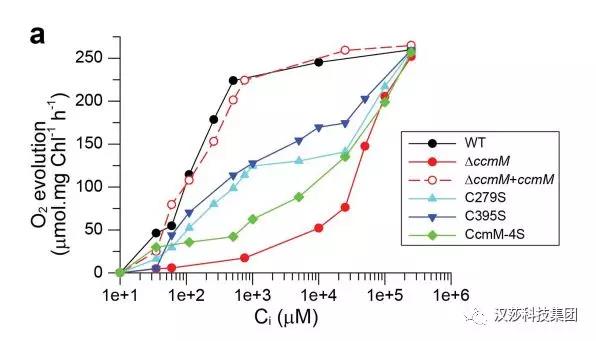
圖4.二硫鍵在SSUL中的羧基功能作用。野生型Se7942和CcmM突變株對外部Ci的光合作用釋放O2速率響應。使用經典Clark型氧電極(Cholorolab2+,Hansatech),通過從10μm到250mm Ci測定不同菌株Se7942對Ci依賴性放氧速率。半胱氨酸突變體(C279S、C395S和CcmM-4s)具有中等的需要CO2表型,而其中CcmM-4s具有最高的二氧化碳需求量。

為了解M35-Rubisco相互作用的分子基礎,他們通過cryo-EM和單粒子分析解析到了復合物結構,在Rubisco“赤道”附近發現了額外的電子密度,通過結構修正,解析了完整的Rubisco–SSUL復合物結構(圖5)。
結構顯示4個SSUL模塊結合一個Rubisco,與RbcL二聚體和RbcS之間的界面通過鹽橋、范德華力等作用力互作。同時,他們發現SSUL與RbcS的互作對此前發現的Rubisco網絡的形成非常重要。
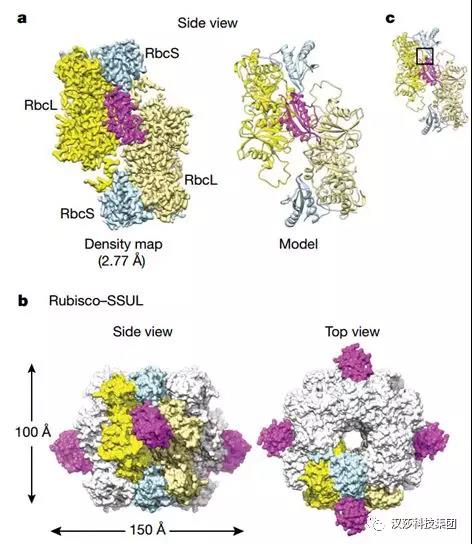
圖5. M35-Rubisco的Cryo-EM結構
因此,Rubisco的液體狀縮合物的形成是通過與SSUL結構域的動態相互作用介導的,而不是通過低復雜性序列介導的,這與其它文獻中的報道結果是一致的。