蛋白質技術專題:多肽的固相合成、切割及純化
固相肽合成(solid phase peptide synthesis, SPPS)技術是現代蛋白質化學的一項關鍵技術,也是對現代分子生物學和基因工程研究具有重大影響和重要意義的技術。它的基本過程為:1、偶聯保護氨基,即將第一個保護氨基以共價鍵偶聯外固相載體上(在合成過程中始終不能脫落)。2、脫保護,在側鍵基團保持穩定條件下脫去氨基上的保護,暴露出自由氨基,例如脫去Fmoc。3、偶聯,將下一個已活化的氨基酸與結合于固相的前一個氨基酸縮合形成肽鍵。4、肽鍵延長,反復進行脫保護與偶聯兩步使肽鍵延長到設計長度。5、切割,將合成的肽由固相載體上切割下來并脫去側鏈保護。6、純化,切割后的肽進行純化、鑒定。下面以合成的huBPP為例,簡介在Pioneer上的合成切割及純化過程:
一、huBPP的合成
(一)儀器及試劑
Pioneer肽合成儀、氬氣,純度99.99%、二甲基甲酰胺(DMF)、哌啶、HATU、二異丙基乙胺、 甲醇、TFA(三氟乙酸)、合成需要的側鍵保護氨基酸、樹脂 Fmoc-PAL-PEG-PS
注:Fmoc-芴甲氧羰基(Fluoreny lmethyl oxoxy carbonyl)
PEG-聚乙二醇
PAL-肽酰胺接頭(peptide amide linker)
PS-樹脂(polystyrene)
(二)合成原理
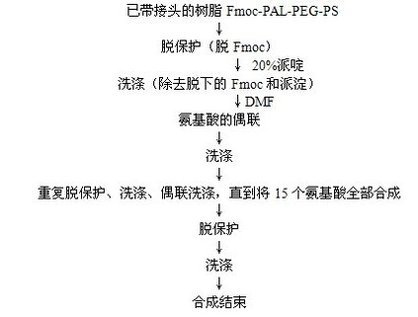
(三)合成過程
準備氣體→沖洗管路→檢查管路→合成準備(裝試劑、輸入序列等)→合成→合成結束
(四)操作程序
1.開機及調節氣壓、檢查是否漏氣
1)依次打開電源開關、UPS開關、計算機
2)安裝所有的瓶子(空)
3)檢查氦氣罐內氣體量(保證剩余量>200PSI),輸出壓力為20PSI
4)打開合成儀電源,等待儀器進入主菜單
5)按Tools-Ding-I/O1
6)打開氣體閥Gas Valve(4) ON回主菜單
7)按Manul-Fluidie System 1 -Wash
8)調節壓力到6±0.2PSI,回主菜單
9)按Tools-Diag-Leak-Start,回主菜單
2.沖洗系統管道
1)按Tools-Bottle
2)在Wash瓶內裝入2L DMF
3)主菜單中按Prime-Prime Individual,回主菜單
4)按Prime-More-Start up/Shut Down-Column 1
5)對Column2重復上一步操作
6)回主菜單
3.檢查每個瓶子的管道
1)按Tools-Bottle
2)在所有瓶內裝入50mL DMF,回主菜單
3)按Prime-Prime Lines-Column1-OK,回主菜單
4)按Manual-Fluidic System1(2或Both,視情況而定) -Wash-Fluid Destination至Wast出現-YES
5)打開Wash瓶,抽出管道-Start,檢查兩個管道是否通暢-Cancel
6)重復以上各步,分別檢查各個管道是否通暢。回主菜單
7)對Column2同樣操作,回主菜單
4.合成準備
1)按Tools-Bottle
2)卸下各個瓶子,裝入用于合成的試劑,回主菜單
3)按Manu1-Transport System1(2或Both) -End
4)在第1至n位中放入氨基酸(放置順序與合成序列相反),第n+2位放一個空管
5)在Transport System視窗中循環按Adv-Align檢查每個位置是否有氨基酸管同時觀察探針運動是否正常
6)按Prime-2-System Prep-Column 1-OK,cancel
7)不要接柱子,對Column2同樣操作
8)裝柱并上柱
9)Prime4-Column Prep-Column 1-OK, 對Column2同樣操作
10)按Tools-Config-Def-OK,回主菜單
11)按Seq-Edit-Ins輸入要合成的序列
12)Seq Menu-Run-Column 1(2或Both) 必要修改參數-OK
13)注:序列輸入以及參數的設置也可以在計算機上進行。
合成
合成
從主菜單按Strt1、Strt2,開始合成,直到結束。
(五)合成結束后處理
小心卸一柱子,倒出肽合成樹脂。若切割時,可按切割程序進入,否則將合成肽樹脂冷凍干燥后保存。
(六)合成過程的檢測報告
1,,資源報告;
2,脫保護圖譜;
3,合成過程UV檢測圖譜
a,脫N端的Fmoc紫外吸收;
b,去Fmoc,洗柱紫外吸收;
c,溶解待合成接上去氨基酸的紫外吸收;
d,偶聯氨基酸到柱子上;
e,洗探針的紫外吸收;
f,如果使用延時合成時對檢測器沖洗的紫外吸收;
g,洗滌柱子的紫外吸收。
二、合成肽的切割
切割(Cleavage)屬于肽合成的后處理部分,是指將已合成的肽從載體(樹脂)上切割下來。有人認為也包括脫去側鏈保護。切割及去保護是合成中最重要步驟。如果試劑和反應條件選擇不當,產物會發生不可逆的修飾而被破壞,因此在切割時應注意以下幾個問題:1、選擇合適的切割及脫保護試劑,根據合成肽氨基酸的不同而選擇;2、選擇合適的試劑濃度、反應時間、溫度等條件;3、氨基酸側鏈的保護,在切割時,切割試劑或切割產物可能對一些對其敏感氨基酸側鏈造成破壞或修飾,因此,反應時要選擇合適試劑和條件,必要時,對敏感側鏈進行保護,使其遭到最小程度的破壞。
(一)切割試劑及條件
試劑配方:TFA/phenyl/water/TIPS=88/5/5/2
條件:
用量 0.5g介質/5ml TFA液
用量 0.5g介質/5ml TFA液
溫度 冰浴中
時間 2h
(二)切割操作流程

(三)切割檢測
1,茚三酮定性反應,檢測介質上huBPP切割是否完全
取4支試管,分別加入①未切割介質;②合成前介質;③已切割介質;④甘氨酸少許,分別加入0.5ml-1ml酸水(<pH3),再加入少許茚三酮,水浴加熱,觀察顏色變化。氨基酸與茚三酮反應呈紫色。
2,HPLC法:檢測切割后肽的純度
HPLC條件:
儀器:Beckman gold system
色譜柱:DiamonsilTM C18 5μl,250×4.6mm,迪馬公司產品
流動相:A: 0.1% TFA
B: 0.1% TFA-CH3CN
洗脫梯度:B: 0~100% 20min
流速:1ml/min
檢測波長:245nm
樣品準備:取切割后水相液體過0.45μl水性膜,取20μl上樣。
結果分析:觀察與對照品的保留時間,峰面積百分比等參數。
三、合成肽的純化
在肽的合成和切割中會產生一不完全肽、反應副產物、殘留試劑等,有必要對肽進行純化。
有關肽的純化和蛋白質純化、鑒定有許多相似之處,如均可用色譜純化,但也在它的特殊性,如分子量太小,不易透析除鹽,一般不易用常規SDS-PAGE鑒定等,所以,它的純化、鑒定應根據肽的特性來設計。HuBPP水溶性好,可以用離子交換色譜如Q-Sepharose FF純化,平衡液pH選在7.0即可。也可以用反相柱純化。下面介紹huBPP的反相純化方法。
(一)儀器及試劑
儀器:Waters 650半制備色譜儀
色譜柱 Prep Park 25×10 Cartridge
內柱:Delta-PakTM C18 100A 15μ
乙腈
(二)純化過程
樣品準備
將切割后水相離心,或過濾除雜,備用
平衡柱子,用H2O平衡柱子,流速3ml/min,到基線平穩
上樣,注入5ml樣品
洗脫:B液:0~60% 30min
分部收集洗脫峰
(三)鑒定
純度鑒定:將各峰分別上HPLC反相柱分析,條件見高效液相色譜實驗中反相色譜部分。
含量測定及計算收率:用Lorry's 法測定切割、純化各步驟中的肽含量度計算收率。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com